
A、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| B、向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2 | ||||
| D、C12通入澄清石灰水中:C12+2OH-=C1-+CIO-+H2O |
| ||


科目:高中化学 来源: 题型:
| A、达到平衡时,两容器中反应物的转化率不同 |
| B、达到平衡时,甲中NH3的体积分数与乙相等 |
| C、达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
| D、乙中的热化学反应方程式为2NH3(g)?N2(g)+3H2(g);△H=+Q2KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X,Y,Z中最简单氢化物稳定性最弱的是Y |
| B、Z元素氧化物对应水化物的酸性一定强于Y元素氧化物对应水化物的酸性 |
| C、X2-的还原性大于Y2- |
| D、Z元素单质在化学反应中只表现出氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol钠含有的电子数为23NA |
| B、标准状况下,22.4L氯气所含的氯原子数为NA |
| C、16g氧气中所含的氧原子数NA |
| D、18g水含有 NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和N2互为等电子体,常温常压下,22.4L的CO与1monN2所含的电子数相等 |
| B、7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1N |
| C、1.0L0.1mol/L的醋酸溶液中含CH3COOH、CH3COO-粒子总数为0.1NA |
| D、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、过量的二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓ |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、春节是我国传统的节日,应把“爆竹声声辞旧岁,总把新桃换旧符”发扬光大 |
| C、近期H7N9型禽流感又在蔓延,应少吃熟的家禽食品 |
| D、“雾霾天气”“温室效应”“光化学烟雾”“PM2.5”等都与汽车尾气排放有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
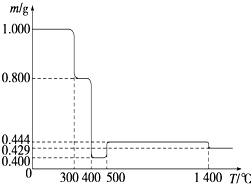 将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com