
【题目】某透明溶液仅含 Na+、F![]() 、B
、B![]() 、Al3+、NO3-、Cl-、SO42-中的 4种离子,所含离子均为 1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
、Al3+、NO3-、Cl-、SO42-中的 4种离子,所含离子均为 1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)溶液中存在的离子是_________________;
(2)写出溶液中加入过量的稀硫酸反应的离子方程式___________________;
(3)向原溶液中滴加足量NaOH 溶液后,过滤洗涤灼烧,最终得到固体质量为_________g。
【答案】Na+、Fe2+、![]() 、
、![]()
![]() 80
80
【解析】
根据溶液中加入硫酸,有气泡,且溶液中阴离子种类不变,说明溶液发生的反应为亚铁离子被硝酸氧化生成一氧化氮,则溶液中存在亚铁离子和硝酸根离子和硫酸根离子,在根据电荷守恒分析,另外存在的离子只能是钠离子。
(1)溶液中加入硫酸,有气泡产生,且溶液中阴离子种类不变,说明不含有钡离子,有硫酸根离子,气体的产生只能是亚铁离子和硝酸根离子在酸性条件下反应生成的一氧化氮,溶液中4种离子,所含离子均为 1mol,根据电荷守恒分析,另外存在的阳离子为钠离子,故溶液中存在Na+、Fe2+、![]() 、
、![]() ;
;
(2)溶液中加入硫酸,是亚铁离子被硝酸氧化,离子方程式为:![]() ;
;
(3)原溶液中加入过量的氢氧化钠,得到氢氧化亚铁,过滤洗涤灼烧,最终得到固体为氧化铁,根据亚铁离子为1mol分析,氧化铁的物质的量为0.5mol,质量为80g。


科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫化钠水解:S2-+2H2O=H2S+2OH-
B.强碱溶液吸收工业制取硝酸产生的尾气:NO2+2OH-=2NO2-+H2O
C.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O
D.向 NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓ +CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为氢气燃烧的实验。发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色。下列说法不正确的是

A. 将烧杯中溶液换成氢硫酸溶液,溶液无明显变化
B. 与酸性FeSO4溶液发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置制备乙酸乙酯。实验如下:
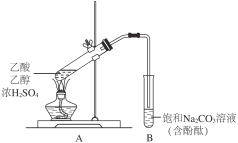
Ⅰ.向2 mL浓H2SO4和2 mL乙醇混合液中滴入2 mL乙酸后,加热试管A;
Ⅱ.一段时间后,试管B中红色溶液上方出现油状液体;
Ⅲ.停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色。
(1)为了加快酯化反应速率,该同学采取的措施有_____________。
(2)欲提高乙酸的转化率,还可采取的措施有_______________。
(3)试管B中溶液显红色的原因是___________(用离子方程式表示)。
(4)Ⅱ中油状液体的成分是__________。
(5)Ⅲ中红色褪去的原因,可能是酚酞溶于乙酸乙酯中。证明该推测的实验方案是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
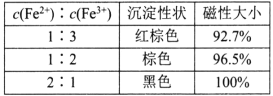
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。检验溶液中还存在Fe2+的方法是___。写出②过程的离子方程式:____。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。检验溶液中还存在Fe2+的方法是___。写出②过程的离子方程式:____。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___。
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的总反应方程式为___。
(3)已知:H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
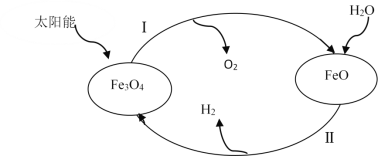
过程I.____,
过程II:3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )
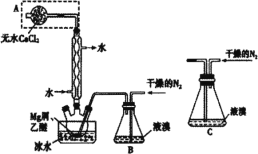
A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com