


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、保存浓硝酸时,通常用棕色瓶并放在阴凉处 |
| B、用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液 |
| C、合成氨的反应中,选择“铁触媒”作催化剂 |
| D、在试管中进行铝和氢氧化钠溶液反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 压强/Mpa/体积分数/%/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 82.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
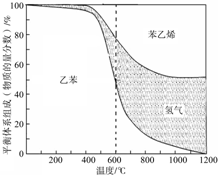 苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl=H2SO4>CH3COOH |
| B、HCl>H2SO4>CH3COOH |
| C、H2SO4>HCl>CH3COOH |
| D、HCl=H2SO4=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(H+)+c(A-)=0.1mol/L |
| C、溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D、与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com