
����Ŀ���밴Ҫ����գ�
��1��д��![]() �к��������ŵ�����_______________��
�к��������ŵ�����_______________��
��2��![]() ����__________����
����__________����
��3��CH2=CH��CH3�ڴ����������������ɾۺ���ķ�Ӧ����ʽΪ________��
��4��д��ʵ��������Ȳ�Ļ�ѧ��Ӧ����ʽ_________________��
��5���ٳ�ȡ3.4gij�л�������A����ȫȼ�պ�����1.8g H2O��8.8g CO2����֪���л��������������������ܶ�Ϊ68������л���ķ���ʽΪ_________________��
�ڸ��л���A�ĺ˴Ź������ͺ���������£�
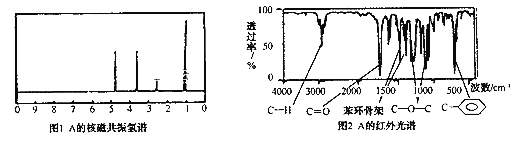
���Ʋ��л���A�Ľṹ��ʽΪ_________________________��
����A����ͬ���л����ͬ���칹�����A����_________�֡�
���𰸡�ȩ�� �� nCH3CH=CH2![]() CaC2+2H2O��Ca(OH)2+CH��CH�� C8H8O2
CaC2+2H2O��Ca(OH)2+CH��CH�� C8H8O2 ![]() 6
6
��������
��1��![]() �к��������ŵ�����ȩ����
�к��������ŵ�����ȩ����
��2��![]() ��������������������
��������������������
��3��CH2=CH��CH3����̼̼˫�����ڴ������������·����Ӿ۷�Ӧ���ɾ۱�ϩ����Ӧ����ʽΪnCH3CH=CH2![]() ��
��
��4��ʵ�����õ�ʯ��ˮ��Ӧ��ȡ��Ȳ����ѧ��Ӧ����ʽ��CaC2+2H2O��Ca(OH)2+CH��CH����
��5���٣�1��n��CO2��=![]() 0.2mol����3.4g�л����У�n��C��=n��CO2��=0.2mol��m��C��=0.2mol��12g/mol=2.4g�� n��H2O��=
0.2mol����3.4g�л����У�n��C��=n��CO2��=0.2mol��m��C��=0.2mol��12g/mol=2.4g�� n��H2O��=![]() 0.1mol����3.4g�л����У�n��H��=2n��H2O��=0.2mol��m��H��=0.2mol��1g/mol=0.2g����2.4g+0.2g����3.4g�������л����л�Ӧ��OԪ�أ���m��O��=3.4g-2.4g-0.2g=0.8g��n��O��=
0.1mol����3.4g�л����У�n��H��=2n��H2O��=0.2mol��m��H��=0.2mol��1g/mol=0.2g����2.4g+0.2g����3.4g�������л����л�Ӧ��OԪ�أ���m��O��=3.4g-2.4g-0.2g=0.8g��n��O��=![]() 0.05mol�����л����У�n��C����n��H����n��O��=0.2mol��0.2mol��0.05mol=4��4��1�����Ը��л�������ʽΪC4H4O����֪���л��������������������ܶ�Ϊ68������л�����Է���������136,���Է���ʽΪΪC8H8O2��
0.05mol�����л����У�n��C����n��H����n��O��=0.2mol��0.2mol��0.05mol=4��4��1�����Ը��л�������ʽΪC4H4O����֪���л��������������������ܶ�Ϊ68������л�����Է���������136,���Է���ʽΪΪC8H8O2��
�ڸ���A�ĺ˴Ź������ף�A��4�ֵ�Ч�⣬������Ϊ3��2��2��1������A�ĺ�����ף�A����![]() ��
��![]() ��
��![]() �ṹ������A�Ľṹ��ʽΪ
�ṹ������A�Ľṹ��ʽΪ![]() ��
��
����A����ͬ���л����ͬ���칹����![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ������
������![]() ����6�֡�
����6�֡�


 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��

A.�ס��ҡ���������ת����ͼ��ʾ����![]()
B.1molCO��ȫȼ�������ȶ�������ų�����Ϊ![]() ����2
����2 ![]()
![]() ��
��![]()
C.��![]() ��
��![]() ������ij�������
������ij�������![]() ��
��![]() ��ַ�Ӧ�ų�������Ϊ
��ַ�Ӧ�ų�������Ϊ![]()
D.�����£�ϡHCl��ϡNaOH��Һ��Ӧ����![]() �ų�����Ϊ
�ų�����Ϊ![]() �����Ȼ�ѧ����ʽΪ
�����Ȼ�ѧ����ʽΪ![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����U�ιܡ�����Ϊmg������������Ϊmg��̼����1L0.2mol��L-1CuCl2��Һ�����ͼ��ʾװ�ã�����˵������ȷ������ ��

A. ��K,���������Ϻ�ɫ��������
B. �պ�K,̼�������Ϻ�ɫ��������
C. �պ�K,̼�����淢���ĵ缫��ӦΪCu2++2e-=Cu
D. �պ�K,����·����0.3NA������ͨ��ʱ��������̼����������������Ϊ9.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij�¶ȣ�t�棩ʱ��ˮ��KW=10-13������¶ȣ�����ڡ����ڻ�С�ڣ�______25�棬�����¶���pH=11��NaOH��ҺaL��pH=1��H2SO4��ҺbL��ϣ�
�������û����ҺΪ���ԣ���a��b=_________��
�������û����ҺpH=2����a��b=__________��
��2����FeCl3��Һ���ɣ����գ����õ�����Ҫ��������� ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�����У���ȷ����
A. �Ȼ�����ӵ��γɹ��̿��õ���ʽ��ʾΪ��![]()
B. 16O�� 18O���������ͺ�������Ų�����ͬ
C. �ȶ��ԣ�CH4��SiH4����ԭ�ԣ�HCl��H2S
D. K����Ca2����Mg2�������Ӱ뾶���μ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�ں����ܱ������н��У��ӷ�Ӧ��ʼ��10sʱ��O2��Ũ�ȼ�����0.3mol/L��0~10s��ƽ����Ӧ����Ϊ
2SO3(g)�ں����ܱ������н��У��ӷ�Ӧ��ʼ��10sʱ��O2��Ũ�ȼ�����0.3mol/L��0~10s��ƽ����Ӧ����Ϊ
A. v(O2)=0.3mol.L-1.s-1B. v(O2)=0.03mol.L-1.s-1
C. v(SO2)=0.03mol.L-1.s-1D. v(SO3)=0.03mol.L-1.s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�ǻ�ѧʵ������������л����Ҵ��������ƾ�����������ˮ����������ζ���ܽ�����ͼ��ʾ�Ķ��ַ�Ӧ��
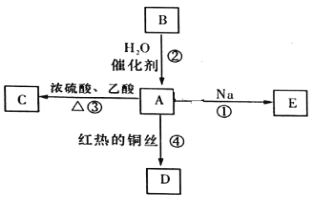
��1��д��D�ķ���ʽ_____________________��
��2��������Ӧ��ʱ����____________________��������Һ����������Һ��ײ�������
��3��д����Ӧ�۵ķ�Ӧ����___________��
��4�����й��ڻ�����B�Ļ�ѧ���ʣ�˵����ȷ����__________������ĸ����
A��������B������Cl2����ȡ����Ӧ
B��������B������Cl2�����ӳɷ�Ӧ
C��������B����ʹ������Ȼ�̼��Һ��ɫ
D��������B������ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣���������;�㷺��������ָʾ���ʹ����Ʊ���һ������ˮ�ܿ����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO�ȣ���ȡCoC2O4��2H2O�����������£�
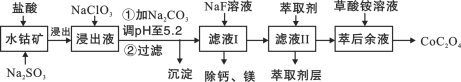
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe��OH)3 | Fe��OH)2 | Co��OH)2 | Al��OH)3 | Mn��OH)2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1�����������м���Na2SO3��Ŀ���ǽ�_____________��ԭ�������ӷ��ţ���
��2��NaClO3�������ǽ�����Һ�е�Fe2+������Fe3+����������Ԫ�ش�����ͻ��ϼۡ��÷�Ӧ�����ӷ���ʽΪ____________��
��3������ƽ���ƶ�ԭ��������Na2CO3��ʹ����Һ��Fe3+��Al3+ת�����������������ԭ���ǣ�________��
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ��
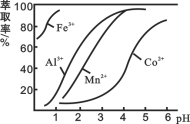
��Һ���м�����ȡ����������_________��ʹ����ȡ�����˵�pH��______��
A���ӽ�2.0 B���ӽ�3.0 C���ӽ�4.0
��5�������ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp��MgF2)=7.35��10-11��Ksp��CaF2)=1.05��10-10�����������NaF��������Һc��Mg2+)/ c ��Ca2+)=____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭSiHCl3(�е㣺31.85 ��)�Ʊ������װ����ͼ��ʾ(�г�װ�ú�β������װ����ȥ)������˵����ȷ����( )

A.װ�â�������ʢװ����ŨH2SO4����ˮ
B.ʵ��ʱ��Ӧ�ȼ��ȹ�ʽ¯���ٴ�ʢװϡ����ķ�Һ©��
C.Ϊ�����ƵõĹ����Ƿ��������ʣ��õ����Լ�����Ϊ�����ᡢ˫��ˮ�����軯����Һ
D.ʵ�����Ʊ�������װ��Ҳ������ʵ�������ü�ʯ�����Ȼ����Һ��Ӧ�Ʊ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com