
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�ص�ԭ����������������֪A��C��Fλ��ͬһ���ڣ�����Ԫ��ԭ�ӵ�����㹲��11�����ӣ���������Ԫ�ص�����������ˮ����֮���������ܷ�Ӧ���������κ�ˮ��DԪ��ԭ�ӵ������������ȴ�����������4����EԪ��ԭ�ӵĴ�����������������������3�����Իش�
(1)д������Ԫ�ص�Ԫ�ط��ţ�B____��D_______��F_______��
(2)�õ���ʽ��ʾB��F�γɵĻ�����_______��
(3)A��C����Ԫ������������ˮ����֮�䷴Ӧ�Ļ�ѧ����ʽΪ______________________________________��C��F����Ԫ������������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ___________________________________________��
(4)F���⻯����γɹ��̿ɱ�ʾΪ_________________________________________�����⻯����ȶ��Ա�D���⻯���ȶ���_________���ǿ������������
(5)�����Ƚ�B��C������ǿ����ʵ�鷽����_______________________________
���𰸡�Mg Si Cl ![]() Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3H+=Al3++3H2O ![]() ǿ þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ���������𰸺���Ҳ���Ը��֣���
ǿ þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ���������𰸺���Ҳ���Ը��֣���
��������
A��B��C��D��E��F���ֶ�����Ԫ�ص�ԭ����������������֪A��C��Fλ��ͬһ���ڣ�����Ԫ��ԭ�ӵ�����㹲��11�����ӣ���������Ԫ�ص�����������ˮ����֮���������ܷ�Ӧ���������κ�ˮ����AΪNa��CΪAl��BΪMg������A��C��F����㹲��11�����ӣ���FΪCl��DԪ��ԭ�ӵ������������ȴ�����������4������DΪSi��EԪ��ԭ�ӵĴ�����������������������3������EΪP��
(1)������������õ�Ԫ�ط��ţ�BΪMg��DΪSi��FΪCl���ʴ�Ϊ��Mg��Si��Cl��
(2) B��F�γɵĻ�����ΪMgCl2������ʽ��������þ�������м䣬�����������������ߣ������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)A��C����Ԫ������������ˮ����ΪNaOH��Al(OH)3������֮�䷴Ӧ����ƫ�����ƺ�ˮ���仯ѧ����ʽΪAl(OH)3+NaOH=NaAlO2+2H2O��C��F����Ԫ������������ˮ����ΪAl(OH)3��HClO4������֮�䷴Ӧ���ɸ���������ˮ�������ӷ���ʽΪAl(OH)3+3H+ =Al3++3H2O���ʴ�Ϊ��Al(OH)3+NaOH=NaAlO2+2H2O��Al(OH)3+3H+=Al3++3H2O��
(4)F���⻯��ΪHCl������ʽ��ʾ���γɹ���Ϊ![]() �����ݷǽ���Խǿ������̬�⻯��Խ�ȶ�����˸��⻯����ȶ��Ա�D���⻯���ȶ���ǿ���ʴ�Ϊ��
�����ݷǽ���Խǿ������̬�⻯��Խ�ȶ�����˸��⻯����ȶ��Ա�D���⻯���ȶ���ǿ���ʴ�Ϊ��![]() ��ǿ��
��ǿ��
(5)�������ֽ�������ˮ���������ᷴӦ������������ʵ���������˱Ƚ�B��C������ǿ����ʵ�鷽����þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ���ʴ�Ϊ��þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ(�����𰸺���Ҳ���Ը���)��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ�����в���ȷ����
A. ��ͬ��ͬѹ�£����������������������ֱ���ȫȼ�գ����߷ų���������
B. �����£�pH��2��������pH��12�İ�ˮ�������ϣ���Һ�ʼ���
C. ���������������Ȼ�茶���ķ�Ӧ�������ȷ�Ӧ
D. �����£�0.1 mol��L��1��NaOH��Һ��0.06 mol��L��1��H2SO4��Һ�������ϣ������Һ��pH��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ,��2 L�ܱ������ڣ�400 ��ʱ������ӦCO(g)+2H2(g) ![]() CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����
CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����

ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
��1��ͼ�б�ʾCH3OH �ı仯��������_______��
��2�����д�ʩ������߷�Ӧ���ʵ���_________(������Ӧ��ĸ���)��
a �����¶� b ������� c ����ѹǿ d ��ʱ�����CH3OH
��3������������˵����Ӧ�ﵽƽ��״̬����__________(������Ӧ��ĸ���)��
a.CO��H2��Ũ�ȱ��ֲ���
b.v(H2)=2 v(CO)
c.CO�����ʵ����������ֲ���
d.�����������ܶȱ��ֲ���
e.ÿ����1molCH3OH��ͬʱ��2molH-H������
��4��CH3OH��O2�ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ��乤��ԭ����ͼ��ʾ��ͼ��CH3OH��__________����A��B��ͨ�룬b���ĵ缫��Ӧʽ��__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���������ȶ�ͬλ��![]() Tl��
Tl��![]() Tl�������й����ͬλ��˵���У�����ȷ���ǣ� ��
Tl�������й����ͬλ��˵���У�����ȷ���ǣ� ��
A. ![]() Tl��
Tl��![]() Tl��������ͬB.
Tl��������ͬB. ![]() Tl��
Tl��![]() Tl��Ϊͬ��������
Tl��Ϊͬ��������
C. ![]() Tl��
Tl��![]() Tl������֮��Ϊ2D.
Tl������֮��Ϊ2D. ![]() Tlԭ�Ӻ�������������������֮��Ϊ43
Tlԭ�Ӻ�������������������֮��Ϊ43
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪCH4(g)��H2O(g)![]() CO(g)��3H2(g)��
CO(g)��3H2(g)��
��1��������ˮ������Ӧ����������Ԫ����____________��Ԫ�ط������𣩣������ɱ�״����35.84 L�ϳ���ʱת�Ƶ��ӵ����ʵ�����________��
��2����2 mol CH4��5 mol H2O(g)ͨ���ݻ�Ϊ10 L�ķ�Ӧ����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

�����ﵽA�������ʱ��Ϊ5 min����v(H2)��____________________��
��ͼ�е�p1______p2(����<����>����������)��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ��_______��
��3���ϳ������ںϳɰ���ʱ���ȥCO��������ӦCO(g)��H2O(g)![]() CO2(g)��H2(g)����H<0�����д�ʩ����ʹ
CO2(g)��H2(g)����H<0�����д�ʩ����ʹ![]() �������________(ѡ����)��
�������________(ѡ����)��
A�������¶� B�����º����³���He(g)
C����H2����ϵ�з��� D����ͨ��һ������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��װ���ڳ����¹�������Һ����仯���Բ��ƣ����պ�K�����ݷ��⣮���������в���ȷ���ǣ� ��
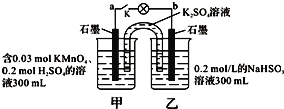
A������·����1.204��1022������ת��ʱ�����ձ�����Һ��H+Ũ��ԼΪ0.1mol/L
B����ع���ʱ�������е�K+������ձ������·�ĵ��ӷ����Ǵ�b��a
C����ع���ʱ�����ձ������ķ�ӦΪMnO4- + 3e- + 4H+ = MnO2 + 2H2O
D���ҳ��е���������ΪSO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����![]() ��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
�ٵμ�Mg��NO3��2��Һ���ڹ��ˣ��۵μ�AgNO3��Һ���ܵμ�Ba(NO3)2��Һ
A.�٢ڢܢڢ�B.�ܢڢ٢ڢ�C.�٢ڢۢڢ�D.�ܢڢۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����������װ���Ʊ�Cu(NH3)xSO4��H2O������ˮ������ɫ����������xֵ��

��Cu(NH3)xSO4��H2O�Ʊ�����ͼ1
��1��A�з����Ļ�ѧ��Ӧ����ʽΪ_____________________________ ��
��2��B�й۲쵽��������_______________________��C��CCl4�������� ______________��
��3������Cu(NH3)xSO4��Һ������Cu(NH3)xSO4��H2O���壬�ɼ����Լ� _______________ ��
��xֵ�IJ�������ͼ2
����һ�����װ�������ԣ���ȡ0.4690g����[M = (178+17x)g/mol]����ƿa�У�
�������ͨ����Һ©������ƿa�еμ�l0%NaOH��Һ��
����������0. 5000 mol/L��NaOH��Һ�ζ�b��ʣ��HCI�����ı�Һ16. 00 mL��
��4��������ķ�Ӧ������ΪCu(NH3)xSO4��NaOH����Һ�з�Ӧ�������ӷ���ʽΪ ______��
��xֵ�ļ�������֤��
��5�����㣺x = __________ ��
��ѧϰС���������ʵ�鲽�裬�������ֵ(x)������ֵƫС��ԭ�����£�
����1������һ�����ڳ�������ƽ���븯ʴȱ��
����2��������� _______________________________________________����д���㣩��
����3 ���������вⶨ��������ʱ���������ƫС���ü���_____���������������������
��6����Լ���l�����ʵ��Ĵ��������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ֪ʶ���������ش����и�С�⡣

��1��������������ͼ1��ʾ��ѧ����沿�ֵ���______(����)��
a������ b������ c���Ҵ� d��������
��2�����и���Ӧ����ͼ2����Ӱ������ʾ��ϵ����_______(����)��
a��������Ũ����
b������������
c���������Ȼ�������Һ
d��ͭ���Ȼ�����Һ
��3�������й�˵����ȷ����_____(����)��
a���˵�վ�Ѻ���ת��Ϊ����
b��������ͭ��Ũ���ᷢ���ۻ�����Ӧ�ܿ�ֹͣ
c����ˮ����ȡ��ѧ���ʾ��漰��������ԭ��Ӧ
d����ⷨ�õ�ijԪ�ص��ʣ����Ԫ�ؿ��ܱ���ԭ��Ҳ���ܱ�����
��4�����и�ʵ������У���Ҫ�������ijЩ�����Ƿ�©ˮ����_______(����)��
a��������ԭ����ͭ
b��ˮ��ú�ͻ�������
c���Ȼ�����Һ����ɳ����
d������100mL 10mol��L-1̼������Һ
��5�����й����Լ������������ȷ����_________(����)��
a������ᱣ���ڲ���ƿ��
b��KOH��Һ�����ڴ���������ϸ��ƿ��
c����ˮ�����ڴ���������ɫƿ��
d��KMnO4���Ҵ����ܷ���ͬһҩƷ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com