
【题目】某小组利用如下装置制备Cu(NH3)xSO4·H2O(溶于水呈深蓝色).并测量x值。

(Cu(NH3)xSO4·H2O制备)见图1
(1)A中发生的化学反应方程式为_____________________________ 。
(2)B中观察到的现象是_______________________;C中CCl4的作用是 ______________。
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂 _______________ 。
(x值的测量)见图2
步骤一:检查装置气密性,称取0.4690g晶体[M = (178+17x)g/mol]于锥形瓶a中;
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液;
步骤三:用0. 5000 mol/L的NaOH标液滴定b中剩余HCI,消耗标液16. 00 mL。
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为 ______。
(x值的计算与论证)
(5)计算:x = __________ ,
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中 _______________________________________________(任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设_____(填“成立”或“不成立”)。
(6)针对假设l,你对实验的处理意见是________________。
【答案】Ca(OH)2+2NH4Cl=△2NH3↑+CaCl2+2H2O由蓝色溶液变为蓝色沉淀,随后沉淀溶解变成深蓝色溶液防止倒吸无水乙醇Cu(NH3)x2++2OH—= Cu(OH)2↓+xNH3↑3.56加入NaOH溶液不足,没有加热或生成氨气未完全溢出等不成立更换砝码完好的托盘天平后,重新进行步骤一到三的全部实验
【解析】
试题(1)A为实验室制取氨气的装置,是利用氯化铵与氢氧化钙固体加热,反应的化学方程式是2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;氨气通入硫酸铜溶液中,开始生成氢氧化铜蓝色沉淀,随着氨气的通入,则氨气与氢氧化铜反应生成四氨合铜离子,后沉淀逐渐溶解,转化为深蓝色溶液;
2NH3↑+CaCl2+2H2O;氨气通入硫酸铜溶液中,开始生成氢氧化铜蓝色沉淀,随着氨气的通入,则氨气与氢氧化铜反应生成四氨合铜离子,后沉淀逐渐溶解,转化为深蓝色溶液;
(2)四氯化碳的密度大于水,因为氨气直接通入水中,会发生倒吸现象,氨气不溶于四氯化碳,通过四氯化碳的缓冲作用,可以防止发生倒吸;
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂无水乙醇,因为乙醇的极性较小,且该晶体在乙醇中的溶解度小于在水中的溶解度,有利于晶体的析出;
(4)Cu(NH3)xSO4与NaOH在溶液中反应,生成硫酸钠、氢氧化铜和氨气,所以反应的离子方程式为Cu(NH3)x2++2OH-= Cu(OH)2↓+xNH3↑;
(5)b中原来HCl的物质的量是0.03L×0.5000mol/L=0.015mol,剩余HCl的物质的量是0.016L×0.5000mol/L=0.008mol,则与氨气反应的HCl的物质的量也是氨气的物质的量是0.015-0.008=0.007mol;则0.4690g/(178+17x)g/mol×x=0.007mol,解得x=3.56;测定结果偏小,可能步骤二加入NaOH溶液不足,没有加热或生成的氨气未完全逸出等;
步骤三中测定结束读数时,体积读数偏小,则说明剩余HCl偏小,则与氨气反应的HCl偏多,则氨气的物质的量偏大,测定结果应偏高,所以不成立;
针对假设l,可更换砝码完好的天平后重新进行步骤一到步骤三全部实验,再进行测定。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确,且能达到目的的是

A. 实验①,设计铜锌双液原电池
B. 实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀
C. 实验③,准确量取一定体积K2CrO7标准溶液
D. 实验④,可用于验证酸性:H2SO4>H2CO3>HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用键线式简化表示,如CH3-CH=CH-CH3可表示为![]() ,有一种有机物X的键线式如图所示。
,有一种有机物X的键线式如图所示。

(1)X的分子式为_______________________。
(2)有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是_____________。
(3)Y在一定条件下可发生反应生成高分子化合物,该反应的化学方程式是_________________。
(4)Y可以与溴水反应,该反应的化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
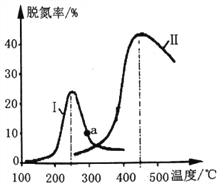
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2![]() SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
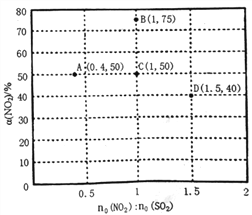
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含I一和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3
溶液的体积V( AgN03)的关系如图所示。已知:Ksp(AgCl)=1.8×l0-10, Ksp( AgI) =l.5xl0-16,则原溶液中c(I一)/c(Cl-)的比值为

A. (V2- Vl)/Vl B. Vl/V2 C. Vl/( V2- Vl) D. V2/Vl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤并转移
⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为____________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、______________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
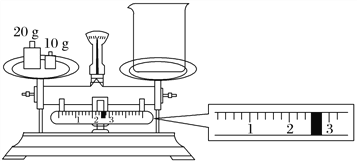
(3)使用容量瓶前必须进行的一步操作是____________________________________________。
(4)在配制过程中,其它操作都是正确的(按烧杯的实际质量),下列操作会引起误差偏低的是________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
C.称量时药品和砝码位置放反
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com