
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
A.含氯气的尾气用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝入硫酸铜溶液即可
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的
浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2SO2(g)+O2(g)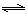 2SO3(g) △H<0,在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如右图所示。下列说法正确的是
2SO3(g) △H<0,在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如右图所示。下列说法正确的是
A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)

查看答案和解析>>
科目:高中化学 来源: 题型:
某学生为测定某氨水中NH3∙H2O的物质的量浓度,进行如下实验(已知硫酸铵溶液呈弱酸性):
I.将浓度为0.1000 mol·L-1的标准硫酸溶液装入洗涤、润洗后的酸式滴定管中,调节液面,记录读数;
II.用碱式滴定管移取20.00 mL待测液于锥形瓶中,并滴几滴甲基橙指示剂;
III.在锥形瓶下垫一张白纸,滴定,记录读数。
IV.再重复上述操作两次。
试填空:
(1)装入标准溶液后,调节液面之前应进行的操作是 ;
(2) III步操作中的锥形瓶下垫一张白纸的作用是 ;
(3)滴定过程发生反应的离子方程式为: ,判断滴定终点依据的实验现象是 ;
(4)硫酸溶液读数如下表所示,按所得数据可得氨水中NH3∙H2O的物质的量浓度为__________。
| 滴定前 | 滴定后 | |
| 第一次 | 0.70 | 16.15 |
| 第二次 | 0.05 | 16.35 |
| 第三次 | 0.35 | 15.70 |
(5)下列操作中会使所测NH3∙H2O的物质的量浓度偏低的是__________。
a.I步操作中未用标准酸溶液润洗滴定管
b.I步操作中改用酚酞试液做酸碱指示剂
c.II步操作中用待测液润洗锥形瓶
d.III步操作后发现滴定管尖嘴部有气泡且未处理
e.读取硫酸体积时,开始时仰视读数,结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加几滴浓盐酸后,立即用另一培养皿扣在上面。

对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>C1一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示a、b、c均为石墨电极,d为碳钢电极,通电
进行电解。假设在电解过程中产生的气体全部逸出,下
列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为 ↑+2H2O
↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重 时,d极产生的气体为
时,d极产生的气体为 (标况)
(标况)

查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2 2NO+O2在定容密闭容器中
反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属溴与氯气的性质很相似。在探究溴单质的性质时,其基本程序应该是
A.做实验并观察实验现象→分析、解释,得出结论
B.观察溴的外观性质→做实验并观察实验现象→分析、解释,得出结论
C.观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论
D.预测溴的性质→做实验并观察实验现象→分析、解释,得出结论→观察溴的外观性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com