
【题目】已知还原性:![]() 。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应
。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应![]() 不考虑Cl2与I2之间的反应
不考虑Cl2与I2之间的反应![]() 。
。
![]() 当
当![]() 时,反应中转移电子的物质的量范围为________________
时,反应中转移电子的物质的量范围为________________![]() 用a表示
用a表示![]() 。
。
![]() 当
当![]() 时,I-的物质的量为_________mol。
时,I-的物质的量为_________mol。
【答案】![]()
![]()
【解析】
还原性:![]() ,向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应,而amolK2SO3完全反应能消耗amol氯气,amolKI完全反应消耗氯气
,向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应,而amolK2SO3完全反应能消耗amol氯气,amolKI完全反应消耗氯气![]() mol,当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气;
mol,当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气;
(1)当![]() 时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应;
时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应;
(2)当![]() 时,SO32-全部氧化为硫酸根,而I-不能全部被氧化。
时,SO32-全部氧化为硫酸根,而I-不能全部被氧化。
(1)当![]() 时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应,故转移的电子的物质的量n(e-)为:
时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应,故转移的电子的物质的量n(e-)为:![]() ,
,
(2)当![]() 时,SO32-全部氧化为硫酸根,而I-不能全部被氧化,故溶液中的硫酸根的物质的量为amol,消耗的氯气为amol,剩余的氯气为(b-a)mol,则能氧化的I-的物质的量为2(b-a)mol,故溶液中的I-的物质的量为a-2(b-a)=(3a-2b)mol。
时,SO32-全部氧化为硫酸根,而I-不能全部被氧化,故溶液中的硫酸根的物质的量为amol,消耗的氯气为amol,剩余的氯气为(b-a)mol,则能氧化的I-的物质的量为2(b-a)mol,故溶液中的I-的物质的量为a-2(b-a)=(3a-2b)mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式_______.(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________左右。
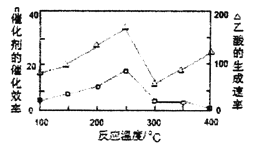
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、![]() 、
、![]() 为原料先制得
为原料先制得![]() ,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示
,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示![]() 图中夹持、固定用的仪器未画出
图中夹持、固定用的仪器未画出![]() 。
。
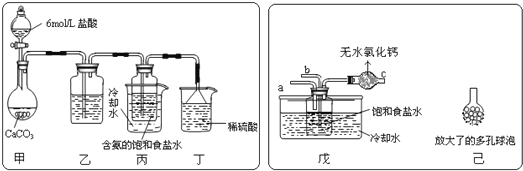
![]() 乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
![]() 另一位同学用图中戊装置
另一位同学用图中戊装置![]() 其他装置未画出
其他装置未画出![]() 进行实验。实验时,须先从______管通入_____气体。
进行实验。实验时,须先从______管通入_____气体。
![]() 有同学建议在戊装置的b管下端连接己装置,理由是________________。
有同学建议在戊装置的b管下端连接己装置,理由是________________。
![]() 下表中所列出的是相关物质在不同温度下的溶解度数据
下表中所列出的是相关物质在不同温度下的溶解度数据![]() 水
水![]() :
:
0 | 10 | 20 | 30 | 40 | 50 | |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____________。
![]() 该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度
该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,将晶体充分干燥后,称量质量为
,将晶体充分干燥后,称量质量为![]() 。再将晶体加热到质量不再变化时,称量所得粉末质量为
。再将晶体加热到质量不再变化时,称量所得粉末质量为![]() 。然后进行下图所示实验:
。然后进行下图所示实验:
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______![]() 填字母
填字母![]() 。
。
a.在加入氯化钙溶液后,振荡、静置,向上层清液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向上层清液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)喷泉实验是中学化学的一个重要性质实验,也是一种自然现象。其产生原因是存在压强差。试根据下图,回答下列问题:

(1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。下列组合中不可能形成喷泉的是________(填字母,下同。)
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
(2)在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸
B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
(3)在图乙的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是________。
A.浓硫酸 B.生石灰
C.硝酸铵 D.烧碱
(4)城市中常见的人造喷泉及火山爆发原理与上述________装置的原理相似。
(5)如果只提供如图丙(烧瓶内充满NH3)的装置,引发喷泉的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.乙二酸与乙二醇在浓硫酸的作用下可以发生酯化反应生成八元环酯
B.新制备的氢氧化铜悬浊液可以鉴别 乙醇、乙酸、乙醛
C.乙炔、乙苯、聚乙烯、乙醇、乙醛都能使酸性KMnO4褪色
D.取某卤代烃少许与氢氧化钠溶液共热,然后加硝酸银溶液,看是否有白色沉淀可以验证某卤代烃中是否含有氯元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
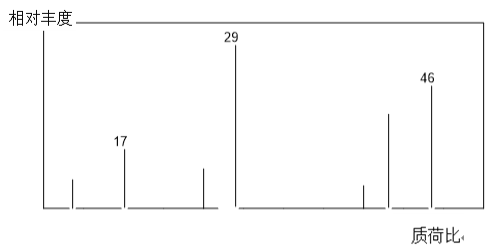
【题目】有机物A常用于食品行业,已知9.2 g A在足量的O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,二者分别增重3.6g和8.8 g,经检验剩余气体为O2。
(1)有机物A的质谱图如下图所示,从图中可知其相对分子质量是___。
(2)A的结构简式为___。
(3)用A进行下列反应
①银镜反应:A在进行银镜反应之前必须在其中加入一定量的_______,因为_______。
②A发生银镜反应的化学方程式为_____________。
③写出A和乙醇反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇.
![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。试写出由
。试写出由![]() 和
和![]() 制取甲醇的热化学方程式:______;
制取甲醇的热化学方程式:______;
![]() 通过下列反应制备甲醇:
通过下列反应制备甲醇:![]() ,图甲是反应时
,图甲是反应时![]() 和
和![]() 的浓度随时间t的变化情况,从反应开始到平衡,用
的浓度随时间t的变化情况,从反应开始到平衡,用![]() 表示平均反应速率
表示平均反应速率![]() ______,平衡时CO的转化______.
______,平衡时CO的转化______.
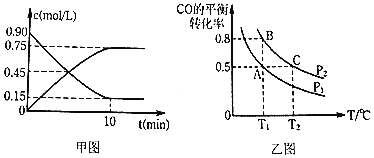
![]() 在一容积可变的密闭容器中充入
在一容积可变的密闭容器中充入![]() 和
和![]() ,CO的平衡转化率随温度
,CO的平衡转化率随温度![]() 、压强
、压强![]() 的变化如图乙所示.
的变化如图乙所示.
![]() 下列说法不能判断该反应达到化学平衡状态的是______
下列说法不能判断该反应达到化学平衡状态的是______![]() 填字母
填字母![]()
A ![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率的2倍
的生成速率的2倍
B ![]() 的体积分数不再改变
的体积分数不再改变
C 体系中![]() 的转化率和CO的转化率相等
的转化率和CO的转化率相等
D 体系中气体的平均摩尔质量不再改变
![]() 比较A、B两点压强大小
比较A、B两点压强大小![]() ______
______![]() 填“
填“![]() 、
、![]() 、
、![]() ”
”![]()
![]() 若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入
若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入![]() 和
和![]() 2,则在平衡状态B时,容器的体积
2,则在平衡状态B时,容器的体积![]() ______L;
______L;
![]() 以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]()
![]() 若KOH溶液足量,则电池负极反应的离子方程式为______;
若KOH溶液足量,则电池负极反应的离子方程式为______;
![]() 若电解质溶液中KOH的物质的量为
若电解质溶液中KOH的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com