
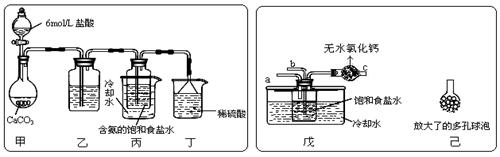
��ҵ���Ը�������Ҫ�ɷ�ΪFeO��Cr2O3����̼���ơ�������������Ϊԭ�������ظ����ƣ�Na2Cr2O7��2H2O��������Ҫ��ӦΪ��
��1��4FeO��Cr2O3 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
��2��2Na2CrO4 + H2SO4 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
����˵����ȷ���ǣ�������
A����Ӧ��1���ͣ�2����Ϊ������ԭ��Ӧ
B����Ӧ��1������������O2����ԭ����FeO��Cr2O3
C�������£�O2��������ǿ��Fe2O3������Na2CrO4
D����Ӧ��1����ÿ����1molNa2CrO4ʱ����ת��3mol
 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ᡢ�����̼�������������г��������ʡ����б�����ȷ���ǣ� ��
A����NaHCO3��Һ�м�����������ʵ�����NaOH����Һ�е�������ֻ��CO ��OH-
��OH-
B��NaHCO3��Һ�У�c (H+)+ c (H2CO3)=c(OH-)
C��10 mL0.10��mol��L-1CH3COOH��Һ��������ʵ�����NaOH����Һ�����ӵ�Ũ���ɴ�С��˳���ǣ�c(Na+)��c(CH3COO-)��c��OH-����c(H+)
D���к������pH����ͬ��HCl��Һ��CH3COOH��Һ�����ĵ�NaOH���ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
28��10�֣�ˮ�ܿ��г�SiO2�⣬����9.24% CoO��2.78% Fe2O3��0.96% MgO��0.084 % CaO�������� ȡ�ܵ���Ҫ�����������£�
ȡ�ܵ���Ҫ�����������£�

��1������ƽ���г����Ļ�ѧ����ʽ��
Fe2(SO4)3�� H2O�� Na2CO3�� Na2Fe6(SO4)4(OH)12���� Na2SO4�� CO2��
��2�������ơ�þ����ԭ����ӦΪ��
MgSO4��2NaF��MgF2����Na2SO4��CaSO4��2NaF��CaF2����Na2SO4
��֪KSP��CaF2����1.11��10-10��KSP��MgF2����7.40��10-11���������NaF��Һ��Ӧ��ȫ����ˣ�����Һ�� ��
��
��3�����������к�����������Ҫ��SO42-��F-�� �� ��������X������ �� ��
��4�����Ȼ�ͭ��Һ�м���һ���������ۺ����ۻ�����ַ�Ӧ������������ܳ��ֵ���________
a����Һ����Cu2+��Fe2+��Al3+��������ΪCu
 b����Һ����Fe2+��Al3+��������ΪCu��Fe
b����Һ����Fe2+��Al3+��������ΪCu��Fe
c����Һ����Fe3+��Al3+��������ΪCu
d����Һ����Fe2+��������ΪCu��Al
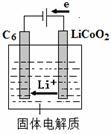
��5��ij����ӵ��������LiCoO2����Li+�������Ϊ����ʡ����ʱ��Li����ԭΪLi������ԭ����ʽǶ���ظ�������̼-6��C6���У���ͼ��ʾ������ط�ӦΪ
 LiCoO2 �� C6 CoO2 �� LiC6 ��д���õ�طŵ�ʱ��������Ӧʽ ��
LiCoO2 �� C6 CoO2 �� LiC6 ��д���õ�طŵ�ʱ��������Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����С�մ��dz��������ֳ�����Ʒ�������������ǵ�������ȷ���� �� ��
A���ֱ��ó�������������Ʒ��ȫ���ֽ�ӷ���û�в��������С�մ�
B���ýྻ��˿պȡ������Ʒ��ú���ƻ��������գ�������ɫ�������Ա仯����С�մ�
C���Ƚ�����Ʒ�����Һ���ֱ����ʯ��ˮ���ް�ɫ�������ɵ���С�մ�
D������ֻ�������ֱ����������������Ʒ���ټ��������ʳ�ף����������ٶȿ����С�մ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����е������������Ӧʱ���������ֹ�������������ͬһ�����ӷ���ʽ��ʾ���ǣ� ��
��̼������Һ������ ��ƫ��������Һ������ �۶�����̼������������Һ
����������Һ�Ͱ�ˮ ���Ȼ����백ˮ ��̼��������Һ�����ʯ��ˮ
A���ۢ� B���٢ۢ� C�����Т� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ֳƻ����������������ԭ�ϣ�����Ҫ�ɷ�ΪFeS2��850��~950��ʱ���������ڿ��������գ����ܷ������з�Ӧ���������N2��O2�����Ϊ4��1����
3FeS2 + 8O2 = Fe3O4 + 6SO2 ��
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 ��
��1������35%����������Ʒ�����ʲ�������FeS2�ĺ���Ϊ_________________��
��2����1 t������FeS2����ʽ��ȫ��Ӧ��������״����SO2__________ m3��
��3��ΪʹFeS2������ȫ����Fe2O3����ҵ��ʹ�ù�������������������20%ʱ������¯����SO2���������Ϊ���٣� ��
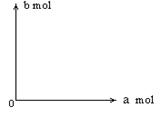 ��4��480 g������FeS2�ڿ�������ȫ��Ӧ�������ù����У�
��4��480 g������FeS2�ڿ�������ȫ��Ӧ�������ù����У�
 Fe��O�����ʵ���֮��n��Fe����n��O�� =4��a��
Fe��O�����ʵ���֮��n��Fe����n��O�� =4��a��
��ʱ���Ŀ���Ϊbmol��
����д��b��a�Ĺ�ϵʽ��___________________��
�ڲ�����b��a�Ĺ�ϵ���ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���ƿ����Ϊ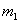 ����ƿ�������������Ϊ
����ƿ�������������Ϊ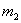 ������ͬ״���£�����Ϊ����ij����Aʱ��������Ϊ
������ͬ״���£�����Ϊ����ij����Aʱ��������Ϊ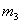 ����A����Է��������ǣ�������
����A����Է��������ǣ�������
A��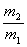 ��29������B��
��29������B��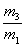 ��29������C��
��29������C��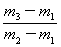 ��29��������D��
��29��������D��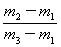 ��29
��29
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȫ�к�20 mL 1 mol /L NaOH��Һ�������ε���Һ�ǣ� ����
A��40 mL 0.1 mol /L���� B��20 mL1 mol /L������Һ
C��10 mL 1 mol /L������Һ D��5mL 1 mol /L������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪���з�Ӧ���Ȼ�ѧ����ʽΪ��
��1��C(s)��O2(g)��CO2(g) ��H 1����393.5kJ/mol
��2��CH3COOH��l����2O2��g����2CO2(g)��2H2O(l) ��H 2����870.3kJ/mol
��3��H2(g)��1/2O2(g)��H2O(l) ��H 3����285.8kJ/mol
��2C(s)��2H2(g)��O2(g)��CH3COOH(l) �ķ�Ӧ�Ȧ�HΪ
A��+488.3 kJ/mol B����488.3 kJ/mol C����244.15 kJ/mol D��+244.15 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com