
【题目】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略)。

已知:①NaClO溶液在受热或酸性条件下易分解,如: 3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl- +2H2O
Ag(NH3) 2++ Cl- +2H2O
③常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3) 2+ :
4 Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+ N2↑+ 4
4Ag↓+ N2↑+ 4![]() + 4NH3↑+H2O
+ 4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是__________________________________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为____________________________________________________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有: 2 mol·L-1水合肼溶液,1 mol·L-1H2SO4 )。
【答案】
(1)水浴加热
(2)4Ag+4NaClO+2H2O![]() 4AgCl+4NaOH+O2↑
4AgCl+4NaOH+O2↑
会释放出氮氧化物(或 NO、NO2 ),造成环境污染
(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中
(4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应
(5)向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1 H2SO4溶液吸收反应中放出的NH3 ,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。
【解析】
分析题中的实验流程可知,第一步氧化是为了把光盘中的少量银转化为氯化银,氯化银难溶于水,过滤后存在于滤渣中;第三步溶解时,氨水把氯化银溶解转化为银氨配离子,最后经一系列操作还原为银。
(1)“氧化”阶段需在 80℃条件下进行,由于加热温度低于水的沸点,所以适宜的加热方式为水浴加热。
(2)因为已知NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,用化合价升降法即可配平,该反应的化学方程式为4Ag+4NaClO+2H2O![]() 4AgCl+4NaOH+O2↑。 HNO3也能氧化Ag,硝酸做氧化剂时通常被还原为有毒的氮的氧化物而污染环境,所以以HNO3代替NaClO的缺点是会释放出氮氧化物(或 NO、NO2 ),造成环境污染 。
4AgCl+4NaOH+O2↑。 HNO3也能氧化Ag,硝酸做氧化剂时通常被还原为有毒的氮的氧化物而污染环境,所以以HNO3代替NaClO的缺点是会释放出氮氧化物(或 NO、NO2 ),造成环境污染 。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,洗涤的目的是为了把滤渣表面残存的银氨配离子洗涤下来,并将洗涤后的滤液合并入过滤Ⅱ的滤液中。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外,还因为未过滤掉的溶液会稀释加入的氨水,氨水的浓度变小,且其中含有一定浓度的Cl-, 不利于AgCl与氨水发生AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl- +2H2O反应 ,使得银的回收率变小。
Ag(NH3) 2++ Cl- +2H2O反应 ,使得银的回收率变小。
(5)“过滤Ⅱ”后的滤液含有银氨配离子,根据题中信息常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3) 2+ :4 Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+ N2↑+ 4
4Ag↓+ N2↑+ 4![]() + 4NH3↑+H2O ,所以首先向该滤液中加入水合肼把银氨配离子充分还原,由于该反应产生所气体中含有氨气,氨气有强烈的刺激性气味会污染空气,所以要设计尾气处理措施,可以用题中提供的、要求必须使用的硫酸作尾气吸收剂把氨气吸收。最后把反应混合物静置、过滤、洗涤、干燥即可得到回收的银。具体方案如下:向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1 H2SO4溶液吸收反应中放出的NH3 ,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。
+ 4NH3↑+H2O ,所以首先向该滤液中加入水合肼把银氨配离子充分还原,由于该反应产生所气体中含有氨气,氨气有强烈的刺激性气味会污染空气,所以要设计尾气处理措施,可以用题中提供的、要求必须使用的硫酸作尾气吸收剂把氨气吸收。最后把反应混合物静置、过滤、洗涤、干燥即可得到回收的银。具体方案如下:向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1 H2SO4溶液吸收反应中放出的NH3 ,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。


科目:高中化学 来源: 题型:
【题目】[2017北京]SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:

① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。

① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______![]() □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
A. CuSO4 B. MgSO4 C. Al(NO3)3 D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
A.乙醇在铜做催化剂下与氧气反应B.乙烯通入酸性高锰酸钾溶液
C.溴乙烷与氢氧化钠的醇溶液共热D.甲苯与氯气混合光照
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12 分)碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。

(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验: ①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A; ②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-![]() CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3∶1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5 mol/L盐酸140 mL,恰好完全溶解,所得溶液还能吸收标况下0.56 L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B. 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C. 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:

(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
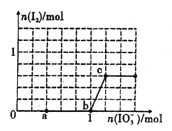
A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com