
����Ŀ�������������ճ��������������Ź㷺��Ӧ�ã���ش��������⣺
��1����������ʹ�õĺϽ���___________��Ŀǰʹ�������Ľ�����________��
��2���������Ͻ����ճ������еij��ò��ϣ�����������ȷ����________��
A.������Ӳ�ȱ������� B.������ʴ��ǿ����������
C.����������Ͻ�ֻ������Ԫ�� D.����һ�������£�����ˮ������Ӧ
E.�������Ũ�����л�ۻ�
��3�����ˮ�е��뼸�α���FeCl3��Һ��������Һ������ĺ��ɫ���÷�Ӧ�����ӷ���ʽΪ__________���γɵķ�ɢϵ�з�ɢ�ʵ���ֱ����Χ��_________��
��4��������������Һ�м���������ƣ��к��ɫ�������ɣ���������Na2O2�����ɵ�O2�����ʵ���֮��Ϊ3��1����д�����������ӷ�Ӧ����ʽ___________________��
��5�����ӹ�ҵ��Ҫ��30%��FeCl3��Һ��ʴ��Ե���ϵ�ͭ������ӡˢ��·�塣��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ��_________________����ʴ��ķ�Һ�м���һ���������۳�ַ�Ӧ������ʣ�࣬��Ӧ�����Һ��һ�����е�������___________�����ܺ��е�������_________������Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ�����������Լ�����������������Ũ������Ũ�������ռ���Ũ��ˮ����Ҫ�õ���һ���Լ���_______��
A.�٢ڢ� B.�٢ۢܢ� C.�ڢܢ� D.�٢ܢ�
��6����������(Na2FeO4)��һ�����;�ˮ�����������Ƶ��Ʊ�����֮һ�ǣ��ڼ�����������NaClO����Fe3+����д���÷�Ӧ�����ӷ�Ӧ����ʽ______________��
��7����һ��������������Ʒ����5 mol/L����140 mL��ǡ����ȫ�ܽ⣬������Һ�������ձ����0.56 L������ǡ��ʹ����Fe2+ȫ��ת����Fe3+����������Ļ�ѧʽ��_____________��
���𰸡���1����ͭ ��
��2��BDE
��3��Fe3++3H2O![]() Fe(OH)3(����)+3H+ 1~100 nm
Fe(OH)3(����)+3H+ 1~100 nm
��4��3Na2O2+2Fe2++4H2O![]() 2Fe(OH)3��+O2��+6Na++2OH
2Fe(OH)3��+O2��+6Na++2OH
��5��2Fe3++Cu![]() 2Fe2++Cu2+ Fe2+��Cu2+��Cl Fe3+ A
2Fe2++Cu2+ Fe2+��Cu2+��Cl Fe3+ A
��6��2Fe(OH)3+3ClO+4OH![]() 2
2![]() +3Cl+5H2O
+3Cl+5H2O
��7��Fe5O7
�����������⿼�����Ԫ�ؼ��仯��������ʡ���1����������ʹ�õĺϽ�����ͭ��Ŀǰʹ�������Ľ���������
��2��A.������Ӳ�ȱ������ͣ�A����B.������ʴ��ǿ���������⣬B��ȷ��C.����������Ͻ𣬻����зǽ���Ԫ�أ�C����D.����һ�������£�����ˮ������Ӧ����������������������D��ȷ��E.�������������Ũ�����л�ۻ���E��ȷ����ѡBDE��
��3�����ˮ�е��뼸�α���FeCl3��Һ��������Һ������ĺ��ɫ�����������������壬�÷�Ӧ�����ӷ���ʽΪFe3++3H2O![]() Fe(OH)3(����)+3H+���γɵķ�ɢϵ�ǽ��壬���з�ɢ�ʵ���ֱ����Χ��1��100nm��
Fe(OH)3(����)+3H+���γɵķ�ɢϵ�ǽ��壬���з�ɢ�ʵ���ֱ����Χ��1��100nm��
��4��������������Һ�м���������ƣ��к��ɫ�������ɣ���������������������������Na2O2�����ɵ�O2�����ʵ���֮��Ϊ3��1�������ԭ���غ�͵��ӵ�ʧ�غ��֪���������ӷ�Ӧ����ʽΪ3Na2O2+2Fe2++4H2O![]() 2Fe(OH)3��+O2��+6Na++2OH��
2Fe(OH)3��+O2��+6Na++2OH��
��5��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽΪ2Fe3++Cu![]() 2Fe2++Cu2+����ʴ��ķ�Һ�м���һ���������۳�ַ�Ӧ������ʣ�࣬˵����ֻ�������ӷ�Ӧ����Ӧ�����Һ��һ�����е�������Fe2+��Cu2+��Cl�����ܺ��е�������Fe3+������Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ������Ҫ������������û���ͭ�����˺������������ᣬȻ���ٹ��ˣ��ϲ���ͨ���������ɵõ��Ȼ�����Һ�������Ҫ���Լ�Ϊ�������������ۡ���Ũ���ᣬ��ѡA��
2Fe2++Cu2+����ʴ��ķ�Һ�м���һ���������۳�ַ�Ӧ������ʣ�࣬˵����ֻ�������ӷ�Ӧ����Ӧ�����Һ��һ�����е�������Fe2+��Cu2+��Cl�����ܺ��е�������Fe3+������Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ������Ҫ������������û���ͭ�����˺������������ᣬȻ���ٹ��ˣ��ϲ���ͨ���������ɵõ��Ȼ�����Һ�������Ҫ���Լ�Ϊ�������������ۡ���Ũ���ᣬ��ѡA��
��6���ڼ�����������NaClO����Fe3+�������ɸ������ƣ��仹ԭ�����������ӣ�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪���÷�Ӧ�����ӷ�Ӧ����ʽΪ2Fe(OH)3+3ClO+4OH![]() 2
2![]() +3Cl+5H2O��
+3Cl+5H2O��
��7����������ʵ�����0.7 mol������0.35 molˮ��������������ԭ�ӵ����ʵ�����0.35 mol��������0.025 mol������������Һ���Ȼ��������ʵ�����(0.70 mol+0.025 mol��2)��3=0.25 mol������ԭ�ӵ����ʵ�����0.25 mol��������ԭ�Ӻ���ԭ�ӵ����ʵ���֮����5�U7����˸�������Ļ�ѧʽ��Fe5O7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����17�֣�
�Ǽ��㶹����һ�����Ƶ���ʯ��ҩ��ϳ�·������ͼ��ʾ��

��֪��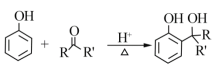
RCOOR'+R'OH![]() RCOOR'+ R'OH��R��R'��R'����������
RCOOR'+ R'OH��R��R'��R'����������
��1��A���ڷ���������ṹ��ʽ��______________________��B�������Ĺ�������________________��
��2��C��D�ķ�Ӧ������___________________��
��3��E����֬�ࡣ�����Ҵ�Ϊ�л�ԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���йػ�ѧ����ʽ��______________________________��
��4����֪��2E![]() F+C2H5OH��F������������
F+C2H5OH��F������������![]() ��___________��
��___________��
��5����D��FΪԭ�Ϻϳ��Ǽ��㶹�ط�Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ����ij��Һ���Ƿ���Cl������ѡ�õ��Լ��� (����)
A. AgNO3��Һ��ϡ���� B. AgNO3��Һ
C. AgNO3��Һ��ϡ���� D. AgNO3��Һ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(15��)ij����С��������·�������һ�ֹ��̽������е�����Ag(������������������ ������,��ʵ���Ӱ��ɺ���)��

��֪:��NaClO��Һ�����Ȼ������������ֽ�,��: 3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
��AgCl�����ڰ�ˮ:AgCl+2NH3��H2O![]() Ag(NH3) 2++ Cl- +2H2O
Ag(NH3) 2++ Cl- +2H2O
������ʱ N2H4��H2O(ˮ����)�ڼ����������ܻ�ԭ Ag(NH3) 2+ :
4 Ag(NH3) 2++N2H4��H2O![]() 4Ag��+ N2��+ 4
4Ag��+ N2��+ 4![]() + 4NH3��+H2O
+ 4NH3��+H2O
��1���������������� 80�������½���,���˵ļ��ȷ�ʽΪ__________________��
��2��NaClO ��Һ�� Ag ��Ӧ�IJ���Ϊ AgCl��NaOH �� O2 ,�÷�Ӧ�Ļ�ѧ����ʽΪ________________�� HNO3Ҳ������Ag,�ӷ�Ӧ����ĽǶȷ���,��HNO3����NaClO��ȱ����__________________________________________��
��3��Ϊ���Ag�Ļ�����,���������������������ϴ��,��_______________________��
��4����ʡ����������,ֱ������ȴ��ķ�Ӧ�����еμ�10%��ˮ,����Ҫ���Ӱ�ˮ������,�������NaClO��NH3��H2O��Ӧ��(��������NaClO3��NH3��H2O����Ӧ),����Ϊ____________________________________________________________��
��5������ƴ��������������Һ�л�ȡ����Ag��ʵ�鷽��:________________________(ʵ������ʹ�����Լ���: 2 mol��L-1ˮ������Һ,1 mol��L-1H2SO4 )��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� [ʵ�黯ѧ]
1-�������һ����Ҫ���л��ϳ��м���,�е�Ϊ71��,�ܶ�Ϊ1.36 g��cm-3��ʵ�����Ʊ�����1-��������Ҫ��������:
����1: ������A�м��������ӡ�12 g��������20 mLˮ,��ˮ��ȴ�»�������28 mLŨH2 SO4 ;��ȴ������,�����¼���24 g NaBr��
����2: ��ͼ��ʾ�ʵ��װ��, ��������,ֱ������״�����Ϊֹ��
����3: �����Һת���Һ©��,�ֳ��л��ࡣ
����4: ���ֳ����л���ת���Һ©��,������12 mL H2O��12 mL 5% Na2CO3��Һ��12 mL H2Oϴ��,��Һ,�ôֲ�Ʒ,��һ���ᴿ��1-����顣

��1������A��������_____________;���������ӵ�Ŀ���ǽ����___________________��
��2����Ӧʱ���ɵ���Ҫ�л���������2-������__________________________________��
��3������2���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����___________________��
��4������2���軺������ʹ��Ӧ������ƽ�Ƚ���,Ŀ����______________________________��
��4������4����5%Na2CO3��Һϴ���л���IJ���: ���Һ©����С�ļ���12 mL 5% Na2CO3��Һ,��,____________,����,��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͬ������,ij�������ռ���1���CO2��3���H2,��������CO2��H2�����ʵ���֮����__________;���������ռ���CO2��H2���������������������,��CO2��H2������֮����_____________��
��2��0.01 molij���ʵ�����Ϊ1.08g�������ʵ�Ħ������Ϊ_________��
��3����֪A�Ƕ��۽���,82 g�ý������������к���6.02 x1023�����������,��������ε�Ħ������Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����
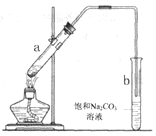
A. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
B. ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹƽ�����������������ķ����ƶ�
C. �Թ�b�б���![]() ��Һ��������������������������������������Ҵ�
��Һ��������������������������������������Ҵ�
D. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com