
【题目】实验室需要4.48L(标准状况下)H2,现用金属锌与足量的稀盐酸反应,问:
(1)至少需要金属锌多少克?
(2)生成氯化锌的物质的量是多少?
科目:高中化学 来源: 题型:
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) ΔH= -612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ΔH= -798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为__________________________________
(2)不同温度下反应CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH的平衡常数如下表所示。
CO2(g) + H2(g) ΔH的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)= 0.005mol/L、c(H2)= 0.015mol/L,则CO的平衡转化率为______。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
A. SO2和SO3浓度相等 B. 容器中混合气体的密度保持不变
C. 容器中气体的压强保持不变 D. SO3的生成速率与SO2的生成速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1______T2 (填“>”或“<");如果想加快正反应的速率,除了改变温度,还可以用___________方法。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不符合ⅦA族元素性质特征的是
A.易形成-1价离子B.从上到下原子半径逐渐减小
C.从上到下非金属性逐渐减弱D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在一定温度下,H2(g)+I2(g)2HI(g)的平衡常数为K1; ![]() H2(g)+
H2(g)+ ![]() I2(g)HI(g)的平衡常数为K2 , 则K1、K2的关系为( )
I2(g)HI(g)的平衡常数为K2 , 则K1、K2的关系为( )
A.K1=K2
B.K1=2K2
C.K1=1/2K2
D.K1=K22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A. 所有的金属常温下都呈固态
B. 金属单质在化学反应中往往体现出还原性
C. 金属都能在空气中形成致密的保护膜
D. 金属元素在自然界中都是以化合态形式存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
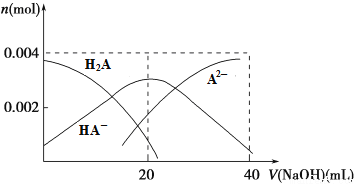
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com