
����Ŀ��ijС��ͬѧ������ͼװ�ÿ�չʵ�飬��ش�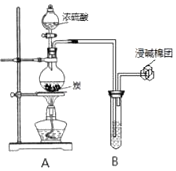
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ �� ��B��ʢװ������ɫʯ����Һ����B�й۲쵽�������� ��
��2����B��ʢװ������������������Һ����B�й۲쵽�������� ��
��3����B��ʢװ��������������ˮ����B�й۲쵽�������� �� B�з�������Ҫ��Ӧ�����ӷ���ʽΪ �� ��B��ʢװ��������H2O2��ˮ��Һ����B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��4����B��ʢװ��������Ʒ����Һ����B�й۲쵽�������� ��
���𰸡�
��1��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O,��ɫʯ����Һ���
CO2��+2SO2��+2H2O,��ɫʯ����Һ���
��2���а�ɫ��������
��3������ɫ��ȥ,Cl2+SO2+2H2O=4H++2Cl��+SO42,SO2+H2O2=H2SO4
��4����ɫ��ȥ
���������⣺��1��̿��Ũ������ȣ���Ӧ���ɶ�����������̼��ˮ������������ˮ��Ӧ���������������������̼������������Ӧ���������ᱵ��̼�ᱵ��������3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ����������������ⷴӦ���������4�������������Ư���ԡ�
��������1��̿��Ũ������ȣ���Ӧ���ɶ�����������̼��ˮ��A�з�Ӧ�ķ���ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O������������ˮ��Ӧ���������ᣬ����B����ɫʯ����Һ��죻������������̼������������Ӧ���������ᱵ��̼�ᱵ������������B��ʢװ������������������Һ����B�й۲쵽���������а�ɫ�������ɣ�3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ������������ˮ����ɫ��ȥ����������Ҫ��Ӧ�����ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42-������������������ⷴӦ�������ᣬ������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2=H2SO4����4�������������Ư���ԣ���ʹƷ����Һ��ɫ������B�й۲쵽�������Ǻ�ɫ��ȥ��
CO2��+2SO2��+2H2O������������ˮ��Ӧ���������ᣬ����B����ɫʯ����Һ��죻������������̼������������Ӧ���������ᱵ��̼�ᱵ������������B��ʢװ������������������Һ����B�й۲쵽���������а�ɫ�������ɣ�3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ������������ˮ����ɫ��ȥ����������Ҫ��Ӧ�����ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42-������������������ⷴӦ�������ᣬ������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2=H2SO4����4�������������Ư���ԣ���ʹƷ����Һ��ɫ������B�й۲쵽�������Ǻ�ɫ��ȥ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�е�̼���ƺ�ˮ����ȫ��Ӧ��CaC2+2H2O�TC2H2��+Ca��OH��2ʹ��Ӧ������������ˮ�������ų�ˮ��������ɼ������״����Ȳ��������Ӷ��ɲⶨ��ʯ��̼���Ƶĺ�����
��1���������������͵�����װʵ��װ�ã�
��� | 1 | 2 | 3 | 4 | 5 | 6 |
���ܼ����� |
|
|
|
|
|
|
ÿ����Ƥ���϶����������� | ||||||
����������������������ʱ�����������͵��ܴ�����ֱ�����ӵ�˳��������������ܵ���ţ��ǣ����������� ��
��2���������Ӻú���ʵ��ʱ�������в�����ÿ�����ֻ����һ�Σ���
�ٳ�ȡһ������ʯ����������3�У�������Ƥ����
�ڼ��װ�õ������ԣ�
��������6��5��ע������ˮ��
�ܴ�����3�ָ�������ʱ����ȡ����4��ˮ�����������2�е�ˮ���Բ��ƣ���
��������������6�Ļ�����ʹˮ��ε��£�������������ʱ���رջ�����
��ȷ�IJ���˳���ò��������д���� ��
��3����ʵ����������������ŵ���ζ���Ҳⶨ���ƫ��������Ϊ��ʯ�к������ʣ�
��4����ʵ��ʱ��ȡ�ĵ�ʯ1.60g�������ų�ˮ�����������ɱ�״����Ȳ�����Ϊ448mL���˵�ʯ��̼���Ƶ����������� %��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ദ��������ʱ�С�����������ȷ����(����)
A.���ճ�����������ȡʳƷ����B.���շϾ����ϣ���ֹ��ɫ��Ⱦ
C.���յ�������������������D.�ı����ʽ��Ԥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�����Ⱦ��˵������ȷ����
A. ������̼���������ЧӦ����Ҫ����
B. ���̲�����һ���ж�������һ����̼
C. ��������������������
D. ����ɫ��Ⱦ����ָһЩ��ɫ������ɵ���Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����Ҫ���л�����ԭ���л���X������������Ϊ��ʼԭ����Ƴ�����ת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ����Y��һ�ֹ��ܸ߷��Ӳ��ϣ� 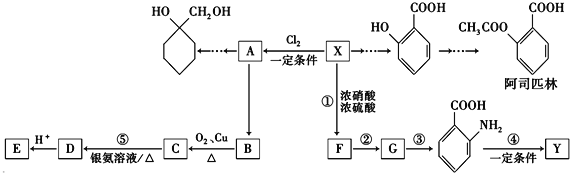
��֪��
��XΪ������������Է�������Ϊ92
��������ڸ�����ص������£��������������Ȼ��� ![]() ��
�� ![]() ���������ױ�������
���������ױ�������
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X�ķ���ʽΪ��
��2�� �й���������Ϊ��
�й���������Ϊ��
��3����Ӧ�۵ķ�Ӧ����������֪AΪһ�ȴ����E�Ľṹ��ʽ����
��4����Ӧ�ܵĻ�ѧ����ʽΪ��
��5����˾ƥ���ж���ͬ���칹�壬��������������ͬ���칹�����֣�
�ٺ��б�����
�ڼȲ��ܷ���ˮ�ⷴӦ��Ҳ���ܷ���������Ӧ��
��1mol���л�������2molNaHCO3��ȫ��Ӧ��
��6�����������ϳ�·�ߣ������ѧ֪ʶ�����һ����AΪԭ���Ʊ� 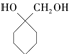 �ĺϳ�·�ߣ����Լ����ã����ϳ�·������ͼʾ�����£�CH3CH2OH
�ĺϳ�·�ߣ����Լ����ã����ϳ�·������ͼʾ�����£�CH3CH2OH ![]() H2C=CH2
H2C=CH2![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǵ���������������ҪԪ��֮һ���Ӵ�ͳ���ϵ���Ϣ���ϵķ�չ�����д�����һ����һ���漣��
��1�������մ�Si3N4���۵�ߡ�Ӳ�ȴ�ѧ�����ȶ�����ҵ�Ͽ��Բ��û�ѧ�������������H2�ı����£�ʹSiCl4��N2��Ӧ����Si3N4������ʯī���棬д���÷�Ӧ�Ļ�ѧ����ʽ��
��2��һ���ù�ҵ�裨�������ء��ơ�����ͭ�����������֪����۵���1420�棬������������ˮ���������Ը�ʴ�����裮һ�ֺϳɵ�����Ĺ�����Ҫ������ͼ�� 
�پ���N2��H2ʱ��ͭм�����������轺����������
���ڵ���¯��3SiO2��s��+2N2��g���TSi3N4��s����H=��727.5kJ/mol����ʼʱΪʲôҪ�ϸ���Ƶ����������Կ����¶�����ϵ��Ҫͨ��������������Ϊ����
��X��������ѡ������ᡱ�������ᡱ�������ᡱ��������ᡱ����
��3����ҵ�Ͽ���ͨ����ͼ2��ʾ��������ȡ���裺
�ٸ��Ʊ����̱����ϸ������ˮ������SiHCl3��ˮ���ҷ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��
�ڼ���ÿһ�ִ��Ʊ�1mol���裬�����������й�Ԫ��û����ʧ����Ӧ����HCl���� ����Ϊ90%����Ӧ����H2��������Ϊ93.75%�����ڵڶ��ִε������У�����Ͷ��HCl��H2�����ʵ���֮���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����һƿ����M�ı�ǩ�Ұ벿���ѱ���ʴ��ʣ�ಿ��ֻ������Na2S����������ͼ��ʾ������֪������Mֻ������Na2SO3��Na2SiO3��Na2SO4�е�һ�֣���ȡ��������M���ϡ��Һ�����й�ʵ�飬����˵������ȷ���ǣ� �� 
A.ֻ������һ���Լ��Ϳ���ȷ���ù���M�ľ���ɷ�
B.����Һ��ͨ�������̼�����а�ɫ�����������MΪNa2SiO3
C.����Һ�м���ϡ�����ữ��BaCl2 �� ���а�ɫ�����������MΪNa2SO4
D.��pH��ֽ���飬��pH=7�������Mһ����Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2 ��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ����
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ����
��3������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ�����
n��SO32������n��HSO3���� | 91��9 | 1��1 | 9��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ���ԣ��û�ѧƽ��ԭ��������
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ���ǣ�ѡ����ĸ������
a��c��Na+��=2c��SO32����+c��HSO3����
b��c��Na+����c��HSO3������c��SO32������c��H+��=c��OH����
c��c��Na+��+c��H+��=c��SO32����+c��HSO3����+c��OH����
��4��������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£� 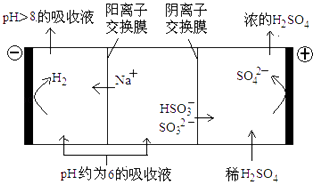
��HSO3���������ŵ�ĵ缫��Ӧʽ����
�ڵ�����������ҺPH����8����ʱ������Һ������ѭ�����ã���������ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����ƵĻ������˵����ȷ�������
��NaCl����������ζƷ��Ҳ�������ȼҵ
��Na2O2�����ں������DZˮͧ�еĹ�����
��Na2CO3ˮ��Һ�Լ��ԣ�������ȥ������
��NaHCO3�����ֽ�ų�CO2 �� ������������㣨 ��
A.ֻ�Т٢ڢ�
B.ֻ�Т٢ۢ�
C.ֻ�Тڢۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com