
【题目】硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹.
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定.工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式;
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅.一种合成氮化硅的工艺主要流程如图: 
①净化N2和H2时,铜屑的作用是;硅胶的作用是;
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了;
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
(3)工业上可以通过如图2所示的流程制取纯硅:
①个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式;
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利 用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是 .
【答案】
(1)3SiCl4+2N2+6H2![]() Si3N4+12HCl
Si3N4+12HCl
(2)除去原料气中的氧气;除去生成的水蒸气;该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);硝酸
(3)3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;5:1
【解析】(1)由信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,反应的化学方程式为:3SiCl4+2N2+6H2![]() Si3N4+12HCl,故答案为:3SiCl4+2N2+6H2
Si3N4+12HCl,故答案为:3SiCl4+2N2+6H2![]() Si3N4+12HCl;(2)①Cu能与氧气反应,则Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气,故答案为:除去原料气中的氧气;除去生成的水蒸气;②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=﹣727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽), 故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,故答案为:硝酸;(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;③反应生产1mol纯硅需补充HCl::
Si3N4+12HCl;(2)①Cu能与氧气反应,则Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气,故答案为:除去原料气中的氧气;除去生成的水蒸气;②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=﹣727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽), 故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,故答案为:硝酸;(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;③反应生产1mol纯硅需补充HCl:: ![]() ﹣3=
﹣3= ![]() ,需补充H2:
,需补充H2: ![]() ﹣1≈0.064,则补充HCl与H2的物质的量之比=
﹣1≈0.064,则补充HCl与H2的物质的量之比= ![]() :0.064≈5:1,故答案为:5:1.(1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;(2)①Cu能与氧气反应,硅胶具有吸水性;②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;②反应生产1mol纯硅需补充HCl:
:0.064≈5:1,故答案为:5:1.(1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;(2)①Cu能与氧气反应,硅胶具有吸水性;②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;②反应生产1mol纯硅需补充HCl: ![]() ﹣3,需补充H2:
﹣3,需补充H2: ![]() ﹣1.
﹣1.
选做题(三选一)(共1小题,满分14分)【化学选修2:化学与技术】


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH﹣)的乘积为1×10﹣18 , 下列说法正确的是( )
A.该溶液可能pH=5
B.该溶液的pH一定是9
C.该溶液的pH可能是7
D.不会有这样的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.SiO2熔点高硬度大,可用于制光导纤维
B.Al2O3是两性氧化物,可用作耐高温材料
C.NaHCO3受热易分解,可用于制胃酸中和剂
D.钠钾合金熔点低,可用作快中子反应堆的热交换剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白.NaClO2溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等四种含氧微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析不正确的是( ) 
A.向亚氯酸钠溶液加水稀释,溶液中n(ClO2)增大
B.HClO2的电离平衡常数Ka=1.0×10﹣6
C.NaClO2溶液中:c(Na+)+c(H+)>c(ClO2﹣)+c(Cl﹣)
D.pH=5时含氯元素的微粒浓度大小关系为:c(HClO2)>c(ClO2﹣)>c(Cl﹣)>c(ClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图装置开展实验,请回答: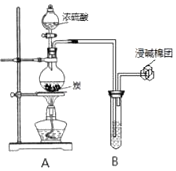
(1)装置A中发生反应的化学方程式为 . 若B中盛装的是紫色石蕊溶液,则B中观察到的现象是 .
(2)若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是 .
(3)若B中盛装的是少量新制氯水,则B中观察到的现象是 , B中发生的主要反应的离子方程式为 . 若B中盛装的是足量H2O2的水溶液,则B中发生反应的化学方程式为 .
(4)若B中盛装的是少量品红溶液,则B中观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1molL﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( ) 
A.M点溶液中水的电离程度比原溶液大
B.在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol
C.随着NaOH的加入, ![]() 不断增大
不断增大
D.当n(NaOH)=0.05mol时溶液中有:c(Cl﹣)>c(Na+)>c(NH4+)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度改变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC﹣CHO)是一种重要的精细化工产品.
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为;
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC﹣CHO(g)+2H2(g)HOCH2CH2OH(g)△H=﹣78kJmol﹣1 K1
2H2(g)+O2(g)2H2O(g)△H=﹣484kJmol﹣1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)OHC﹣CHO(g)+2H2O(g)的△H=kJmol﹣1;相同温度下,该反应的化学平衡常数K=(用含K1、K2的代数式表示);
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图1所示.反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是、;
(3)Ⅱ.乙二醛电解氧化制备乙醛酸(OHC﹣COOH)的生产装置如图2所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
①阴极反应式为;
②阳极液中盐酸的作用,除了产生氯气外,还有;
③保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=;
(设:法拉第常数为f Cmol﹣1;η= ![]() ×100% )
×100% )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早生产和研究合金的国家之一。春秋战国时期的名剑“干将”、“莫邪”性能远优于当时普遍使用的青铜剑,它们的合金成分可能是( )
A.钠合金B.硬铝C.生铁D.钛合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com