
【题目】下列叙述正确的是
A. 氯化铵溶于水体系温度降低,这个变化是吸热反应
B. 甲烷可用作燃料,说明甲烷燃烧是放热反应
C. 生成物总能量一定低于反应物总能量
D. 同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
科目:高中化学 来源: 题型:
【题目】【2017枣阳市校级一模】下列保存物质的方法正确的是( )
A.保存液溴时向其中加入少量酒精,减少挥发
B.氢氟酸保存在塑料塞的玻璃瓶中,防止瓶口和塞子粘住
C.氨水易挥发,应密封在低温处保存
D.金属锂应保存在煤油中,防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实。[18]-轮烯是一种大环轮烯,其结构简式如图所示。 有关它的说法正确的是
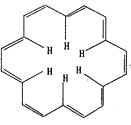
A. [18]- 轮烯分子中所有原子不可能处于同一平面
B. [18]- 轮烯的分子式为:C18H12
C. 1 mol[18]- 轮烯最多可与9 mol氢气发生加成反应生成环烷烃
D. [18]- 轮烯与乙烯互为同系物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
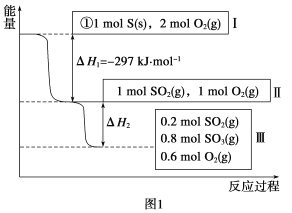
①写出能表示硫的燃烧热的热化学方程式:________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
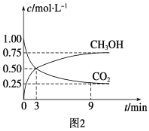
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能大量共存的离子组是
A. NH4+、SO42-、Al3+、Cl-
B. Na+、OH-、K+、Cl-
C. MnO4-、K+、SO42-、Na+
D. K+、NO3-、I-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
A.(m-16)g B.(m+16)g C.(m-32 )g D.16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的1,2﹣二氯乙烷,可采取的方法是( )
A.乙烯与氯化氢加成
B.乙烯与氯气加成
C.乙烷与氯气以1:2的体积比在光照条件下反应
D.乙烯先与氯化氢加成,再与等物质的量的氯气在光照下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用丙炔合成2-甲基丙烯酸甲酯(![]() )的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物,这些物质可以是
)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物,这些物质可以是
A.CO和CH3OH B.CO2和H2O C.H2和CO D.CH3OH和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.00 | |
2 | 0.10 | 22.46 | 20.00 |
3 | 0.10 | 22.54 | 20.00 |
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为_________mL。滴定达到终点的现象是_____________________。
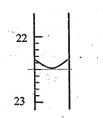
(2)根据上述数据,可计算出该盐酸的浓度为___________。
(3)在上述实验中,下列操作会造成测定结果偏高的有___________
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com