
【题目】下列叙述正确的是( )
A.丁醇的同分异构体![]() 不含立体异构
不含立体异构![]() 有7种
有7种
B.棉、丝、塑料及合成橡胶完全燃烧都只生成CO2和H2O
C.C6H5Li+CO2→C6H5COOLi既不属于加成反应也不属于取代反应
D.乙烯能使溴水褪色、乙醇能使酸性KMnO4溶液褪色,发生的反应类型相同
科目:高中化学 来源: 题型:
【题目】镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如下:

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是____________;“滤渣1”的主要成分为____________。
(2)“转化Ⅰ”的目的为___________________(用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为__________________。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,________(选填“能”或“不能”)达到目的,“试剂X”可以是________(填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________;“转化Ⅱ”中发生反应的离子方程式为________。
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置连接好后,电流计指针发生了偏转,下列说法中正确的是
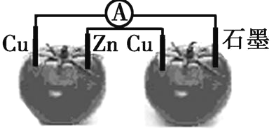
A.两个番茄及相关电极均构成了原电池
B.锌是负极
C.电子移动:锌→铜(右)→番茄→石墨→铜(左)
D.两个铜片上均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室用浓硫酸和乙醇在170℃的条件下制备乙烯(140℃时生成乙醚)。某学习小组设计实验证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷(装置可以重复使用)。
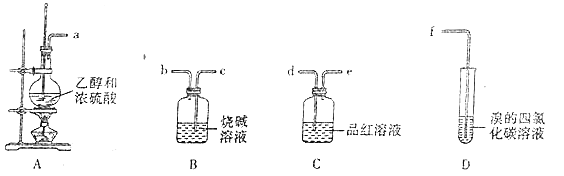
下列说法错误的是( )
A. 加热时迅速将温度升高至170℃,减少生成副产品
B. 导管接口连接顺序为a→d→e→c→b→d→e→f
C. 装置B中的试剂可以换成酸性高锰酸钾溶液
D. 实验完毕后,采用蒸馏操作分离提纯1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是
A.Na2SO3试样![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
结论:此Na2SO3试样已变质
B.稀硫酸![]() 产生量少气泡
产生量少气泡![]() 产生大量气泡
产生大量气泡
结论:CuSO4对此反应有催化作用
C.某溶液![]() 冒着白雾
冒着白雾![]() 产生白烟,
产生白烟,
结论:此溶液为浓盐酸
D.无色试液![]() 呈黄色
呈黄色
结论:此溶液一定含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
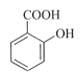 +(CH3CO)2O
+(CH3CO)2O![]()
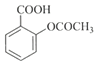 +CH3COOH
+CH3COOH
水杨酸 酸酐 乙酰水杨酸
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~74 | 135~138 |
相对密度/(g/cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中最好采用__________加热(填标号)。
A. 酒精灯 B.热水浴 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号)。
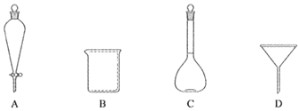
(3)①中需使用冷水,目的是_________________________。
(4)②中的主要化学反应方程式是:____________________。
(5)④采用的纯化方法为____________。
(6)本实验的产率为_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
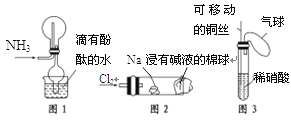
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3。。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A---B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
i. 下图是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。
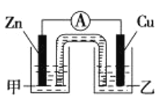
①该原电池的正极为 ____ ,其外电路中的电子是从____ 极(填“Zn”或“Cu”)流出。
②电解质溶液乙是______溶液,Zn极的电极反应式是_______ 。
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是_____。
ii. 下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
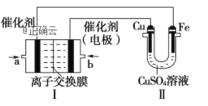
①同学想在Ⅱ中实现铁上镀铜,则Cu作____极,电极反应式为______,当线路中有0.1mol电子通过时,阴极增重_____ g。Ⅰ中消耗氧气体积是_____L(标况下)。
②a处通入的是____(填“CH4”或“O2”),b处电极上发生的电极反应式是___。Ⅰ中的总反应方程式为___。
③该同学若将Ⅱ中的两个电极都换成铂电极,当线路中有0.1mol电子通过时,测得溶液pH=______(100mL的CuSO4溶液),则Ⅱ中的总反应方程式为 _______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com