
【题目】根据下列事实得出的结论正确的是
A.Na2SO3试样![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
结论:此Na2SO3试样已变质
B.稀硫酸![]() 产生量少气泡
产生量少气泡![]() 产生大量气泡
产生大量气泡
结论:CuSO4对此反应有催化作用
C.某溶液![]() 冒着白雾
冒着白雾![]() 产生白烟,
产生白烟,
结论:此溶液为浓盐酸
D.无色试液![]() 呈黄色
呈黄色
结论:此溶液一定含有Na+
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是( )
A.CH3CH(C2H5)CH3 2-甲基丁烷
B.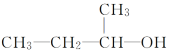 1-甲基-1丙醇
1-甲基-1丙醇
C.CH2BrCH2Br 二溴乙烷
D.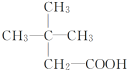 2,2-二甲基丁酸
2,2-二甲基丁酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙烯、SO2能使酸性高锰酸钾溶液褪色,其褪色原理相同
B.CO和H2混合气体和氧气中充分燃烧,只要混合气体总物质的量一定,消耗氧气的量一定
C.乙醛在一定条件下能与氢气反应生成乙醇,发生了还原反应
D.CH2=CH2+HCl![]() CH3CH2Cl该有机反应应为取代反应
CH3CH2Cl该有机反应应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )
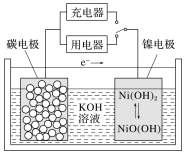
A.充电时,阴极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O
B.放电时,负极的电极反应为:H2-2e-=2H+
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物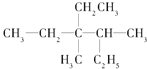 用系统命名法命名: ______________
用系统命名法命名: ______________
2-甲基苯甲酸乙酯的结构简式是_______________________
(2)有机物X、Y、Z在一定条件下可实现如下转化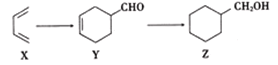
则①X的核磁共振氢谱有________组峰,面积比为_________
②Y→Z的反应类型是_____________
③Z的六元环上的一氯代物共有_________种
(3)如图是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素.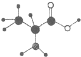 则:
则:
①其分子式为 _________________
②它能通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.丁醇的同分异构体![]() 不含立体异构
不含立体异构![]() 有7种
有7种
B.棉、丝、塑料及合成橡胶完全燃烧都只生成CO2和H2O
C.C6H5Li+CO2→C6H5COOLi既不属于加成反应也不属于取代反应
D.乙烯能使溴水褪色、乙醇能使酸性KMnO4溶液褪色,发生的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 水、乙醇、乙酸都属于弱电解质
B. 苯与氯气生成 的反应属于取代反应
的反应属于取代反应
C. 分子式为C9H12的芳香烃共有8种
D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,![]() 二溴乙烷的装置如图所示:
二溴乙烷的装置如图所示:
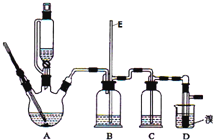
提示:乙醇与浓硫酸在![]() 时脱水生成乙醚,在
时脱水生成乙醚,在![]() 时脱水生成乙烯.有关数据列表如下:
时脱水生成乙烯.有关数据列表如下:
乙醇 | 1, | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 | 0.79 | 2.2 | 0.71 |
沸点 | 78.5 | 132 | 34.6 |
熔点 | -130 | 9 | -116 |
回答下列问题:
![]() 装置D中发生主要反应的化学方程式为 ______
装置D中发生主要反应的化学方程式为 ______
![]() 装置B的作用 ______ ,长玻璃管E的作用 ______
装置B的作用 ______ ,长玻璃管E的作用 ______
![]() 在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体
在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 浓硫酸
浓硫酸![]() 氢氧化钠溶液
氢氧化钠溶液![]() 饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
![]() 反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却
反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却![]() 如用冰水
如用冰水![]() ,其原因是 ______ ;将1,
,其原因是 ______ ;将1,![]() 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层
二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层![]() 填“上”、“下”
填“上”、“下”![]()
![]() 若产物中有少量未反应的
若产物中有少量未反应的![]() ,最好用 ______ 洗涤除去
,最好用 ______ 洗涤除去![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 氢氧化钠溶液
氢氧化钠溶液![]() 碘化钠溶液
碘化钠溶液![]() 乙醇
乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为0.01mol/L的几种溶液:①盐酸 ②醋酸③氨水④ NaOH溶液。回答下列问题:
(1)②的电离方程式为________ ; ③,④中水的电离程度较大的是______
(2)室温下,溶液①中由水电离产生c(H+)=______;当温度升高到100摄氏度时,(Kw=1×10-12)溶液④的pH= ______
(3)将①、③等体积混合,所得溶液呈______ (填酸,碱或中)性。
(4)将②、④等体积混合后,若溶液呈中性,则消耗两溶液的体积为②_____ ④(填“>”、“<”或“=”)
(5)室温时,若用标准溶液①滴定④,滴定过程中,需要加入_______作指示剂,滴定终点的判断方法是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com