
【题目】下列说法不正确的是( )
A.己烷有4种同分异构体,它们的熔点、沸点各不相同
B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C.油脂皂化反应得到高级脂肪酸盐与甘油
D.聚合物 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
【答案】A
【解析】A、己烷有5种同分异构体,分别是己烷(CH3CH2CH2CH2CH2CH3)、2—甲基戊烷[(CH3)2CH2CH2CH2CH3]、3—甲基戊烷[CH3CH2CH(CH3)CH2CH3]、2,3—甲基丁烷[(CH3)2CHCH(CH3)2]、2,2—甲基丁烷[(CH3)3CCH2CH3],A不正确。B、有机物中的原子或原子团被其它原子或原子团所代替的反应是取代反应,在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应,B正确;C、油脂在碱性条件下的水解反应是皂化反应,油脂通过皂化反应可以得到高级脂肪酸盐与甘油,C正确;D、根据高分子化合物的结构可知,该化合物是加聚产物,依据链节可知其单体是丙烯和乙烯,D正确,答案选A。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
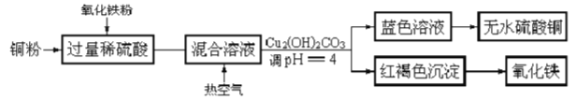
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如上图所示:稀硫酸和氧化铁反应的离子方程式是_________________________;铜和上述反应得到的物质反应的离子方程式是_______________;向混合溶液中通入热空气的反应的离子方程式是____________________;分离蓝色滤液和红褐色沉淀的实验操作是_____________________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
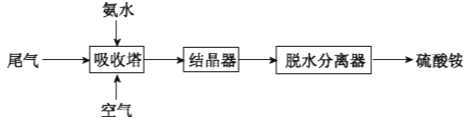
①吸收塔中发生反应的化学方程式是_________。
②检验硫酸铵中的NH4+的操作是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在我们把无污染、无公害的食品叫做“绿色食品”,而最初,专家把绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”,根据最初的说法,下列属于“蓝色食品”的是( )
A.大米B.海带C.食醋D.西红柿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行两组电解实验。
实验一:已知固体电解质只有特定离子才能移动。按照下图装置研究α-AgI固体电解质导体是Ag+导电还是I-导电;

实验二:用惰性电极电解硫酸铜和盐酸混合液,对产生的气体进行研究。
关于以上实验,下列说法正确的是
A. 实验一:若α-AgI固体是Ag+导电,则通电一段时间后的晶体密度不均匀
B. 实验一:若α-AgI固体是I-导电,则通电一段时间后的晶体密度仍均匀
C. 实验二:若阳极为纯净气体,阴、阳两极产生的气体体积比可能≥1
D. 实验二:若阳极为混合气体,阴、阳两极产生的气体体积比可能≥1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2的电子式是________。
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g)+H2 (g)![]() CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH(g)的热化学方程式是________。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。

(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“I”“II”或“III”)。
②T3时,反应I的v(正)________v(逆)(填“>”“<”或“=”)。
③温度为T5时,该反应的平衡常数K=________。
(4)甲醇合成甲醚的反应为2CH3OH(g)![]() CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)![]() C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:

①反应速率较快的是________(填“Ⅰ”或“Ⅱ”),原因是________。
②根据反应原理,分析增大压强对合成甲醚的影响________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g)![]() H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
A.混合气体的颜色不再变化
B.温度和体积一定时,容器内压强不再变化
C.1molH-H键生成的同时有2molH-I键断裂
D.各物质的物质的量浓度之比为2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、C1-中的若干种,现取X溶液进行连续实验,实验过程及产物如图.说法正确的是

A. X中肯定存在Fe2+、A13+、NH4+、SO42- B. X中不能确定的离子是 A13+和C1-
C. 沉淀I一定是Al(OH)3 D. 溶液E和气体F不能发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com