
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应. 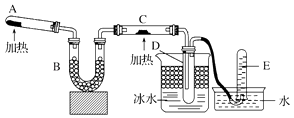
回答下列问题:
(1)A中加入的物质是 , 发生反应的化学方程式是;
(2)B中加入的物质是 , 其作用是;
(3)实验时在C中发生反应的化学方程式是 .
【答案】
(1)固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(OH)2 ![]() CaCl2+NH3↑+2H2O
CaCl2+NH3↑+2H2O
(2)碱石灰;除去氨气中的水蒸气
(3)2NH3+3CuO ![]() N2+3H2O+3Cu
N2+3H2O+3Cu
【解析】解:(1)根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜,可知A中加入的是氯化铵和氢氧化钙的固体混合物,加热来制取氨气,发生反应的化学方程式是:2NH4Cl+Ca(OH)2 ![]() CaCl2+NH3↑+2H2O,所以答案是:固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(OH)2
CaCl2+NH3↑+2H2O,所以答案是:固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(OH)2 ![]() CaCl2+NH3↑+2H2O;(2)制得的氨气中含有杂质水,可以用碱石灰来吸收,所以答案是:碱石灰;除去氨气中的水蒸气;(3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,反应的化学方程式为2NH3+3CuO
CaCl2+NH3↑+2H2O;(2)制得的氨气中含有杂质水,可以用碱石灰来吸收,所以答案是:碱石灰;除去氨气中的水蒸气;(3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,反应的化学方程式为2NH3+3CuO ![]() N2+3H2O+3Cu, 所以答案是:2NH3+3CuO
N2+3H2O+3Cu, 所以答案是:2NH3+3CuO ![]() N2+3H2O+3Cu.
N2+3H2O+3Cu.
【考点精析】利用氨的化学性质对题目进行判断即可得到答案,需要熟知与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)把盛满NO2和O2的混合气体的试管倒立于水中.
①若一段时间内水上升且充满试管,则原混合气体中NO2和O2的体积比是 , 若假设生成的溶质不向外扩散,且为标准状况.则所得溶液的物质的量浓度应为 . (保留二位有效数字)
②若一段时间后上升的水只升到试管容积的一半,则剩余的气体为(用化学式表示).原混合气体中,NO2和O2的体积比是 .
(2)二氧化氮和氨气在一定条件下,充分反应,得到非常稳定的产物,其化学方程式为:6NO2+8NH3=7N2+12H2O,若20mlNO2和NH3的混合气体在一定条件下发生上述反应,已知实际参加反应的NO2比NH3少2mL,则原混合气体中NO2和NH3的物质的量之比可能为
A.3:4
B.3:2
C.1:2
D.3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60g
B.6.02×1023个偏二甲肼分子的质量约为60g
C.1mol偏二甲肼的质量为60g/mol
D.6g偏二甲肼含有1.2NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述正确的是( )
A.稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.配制1molL﹣1 300mL NaCl溶液可以选择一个50mL的容量瓶和一个250mL的容量瓶
D.可以用如图装置进行氯气的尾气处理 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJmol﹣1
BaS(s)=Ba(s)+S(s)△H=+460kJmol﹣1
已知:2C(s)+O2(g)=2CO(g)△H=﹣221kJmol﹣1则Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3﹣=2H3AsO4+3S+10NO2↑+2H2O,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 .
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS﹣、S2﹣)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).①含硫物种B表示 . 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母).
a.c(Na+)=c(H2S)+c(HS﹣)+2c(S2﹣)
b.2c(Na+)=c(H2S)+c(HS﹣)+c(S2﹣)
c.c(Na+)=3[c(H2S)+c(HS﹣)+c(S2﹣)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示).
(4)硫的有机物( ![]() )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. ![]() 及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为 ![]() 的核磁共振氢谱图.写出X的结构简式: .
的核磁共振氢谱图.写出X的结构简式: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)![]() 2H2S(g)K 1 △H1 (1)
2H2S(g)K 1 △H1 (1)
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 △H2(2)
2H2O(g)+H2(g)K2 △H2(2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)的△H=________。
S2(g)+4H2O(g)的△H=________。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08molL-1min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为_______(填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8molH2、1.2molS2,建立平衡时测得S2的转化率为25%,据此判断△H1________0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________(写出主要反应的离子方程式),该溶液中,[Na+]________2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数=________molL-1。
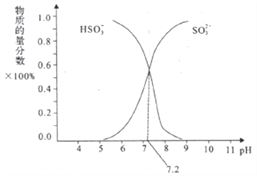
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL0.1mol/ LNH4HSO4溶液中滴入0.1mol/LNaOH 溶液至恰好反应完全,下列说法正确的是( )
A. 整个反应过程中: c(H+)+ c(Na+)+ c(NH4+)=c(OH-)+ c(SO42-)
B. 当滴入30mLNaOH 溶液时(pH>7) :c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C. 当滴入20mL NaOH 溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+')
D. 当溶液呈中性时: c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R,X,T,Z,Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( ) 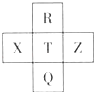
A.非金属性:Z<T<X
B.R与Q原子核外电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:X>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 1摩尔任何集体都含有6.02×1023个分子
D. 1mol氧含6.02×1023个O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com