
【题目】已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)![]() 2H2S(g)K 1 △H1 (1)
2H2S(g)K 1 △H1 (1)
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 △H2(2)
2H2O(g)+H2(g)K2 △H2(2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)的△H=________。
S2(g)+4H2O(g)的△H=________。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08molL-1min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为_______(填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8molH2、1.2molS2,建立平衡时测得S2的转化率为25%,据此判断△H1________0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________(写出主要反应的离子方程式),该溶液中,[Na+]________2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数=________molL-1。
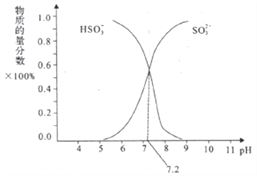
【答案】 △H=2△H2-△H1 正向 < SO32-+H2O![]() HSO3-+OH- > 10-6.8
HSO3-+OH- > 10-6.8
【解析】本题主要考查关于平衡常数的计算。
(1)反应2(2)-(1)可得4H2(g)+2SO2(g)![]() S2(g)+4H2O(g) △H=△H=2△H2-△H1。
S2(g)+4H2O(g) △H=△H=2△H2-△H1。
(2)①温度为T1,平衡浓度为:c(H2S)=0.8molL-1,c(H2)=(1.8-0.8)molL-1=1.0molL-1,c(S2)=(1.2-0.4)molL-1=0.8molL-1,平衡常数K1=![]() =0.8,若此时再向容器中充入H2、S2、H2S各0.8mol,各物质浓度为c(H2S)=1.6molL-1,c(H2)=1.8molL-1,c(S2)=1.6molL-1,浓度商Qc=40/81<K=0.8,则平衡移动方向为正向;
=0.8,若此时再向容器中充入H2、S2、H2S各0.8mol,各物质浓度为c(H2S)=1.6molL-1,c(H2)=1.8molL-1,c(S2)=1.6molL-1,浓度商Qc=40/81<K=0.8,则平衡移动方向为正向;
②温度为T1,平衡时S2的转化率为0.4/1.2=1/3>25%,温度为T2时(T2>Tl),平衡常数K减小,表明升温平衡左移,据此判断△H1<0;
(3)①已知Na2SO3水溶液显碱性,原因是SO32-+H2O![]() HSO3-+OH-,该溶液中,[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],所以[Na+]>2[SO32-]+[HSO3-]。
HSO3-+OH-,该溶液中,[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],所以[Na+]>2[SO32-]+[HSO3-]。
②SO32-+H2O![]() HSO3-+OH-,SO32-的水解平衡常数Kh=
HSO3-+OH-,SO32-的水解平衡常数Kh=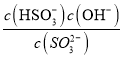 ,当pH=7.2时,c(SO32-)=c(HSO3-),Kh= c(OH-)=
,当pH=7.2时,c(SO32-)=c(HSO3-),Kh= c(OH-)=![]() =
=![]() molL-1=10-6.8molL-1。
molL-1=10-6.8molL-1。


科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( ) 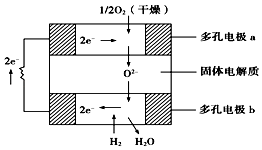
A.有O2参加反应的a极为电池的负极
B.b极的电极反应式为H2+O2﹣﹣2e﹣═H2O
C.a极对应的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.氧化锆的作用是让电子在电池内部通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
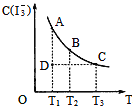
A. 反应I2(aq)+I-(aq)=I3-(aq)△H<0
B. 若温度为T1、T2反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R,X,T,Z,Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( ) 
A.非金属性:Z<T<X
B.R与Q原子核外电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:X>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应. 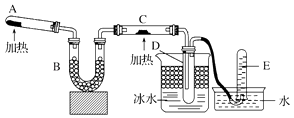
回答下列问题:
(1)A中加入的物质是 , 发生反应的化学方程式是;
(2)B中加入的物质是 , 其作用是;
(3)实验时在C中发生反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.用惰性电极电解氯化镁溶液:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
B.一定量Cl2通入FeI2溶液中,完全反应后测得溶液中c(Fe3+)=c(Fe2+):5Cl2+8I﹣+2Fe2+=4I2+2Fe3++10Cl﹣
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2Br﹣COOH+OH﹣ ![]() CH2Br﹣COO﹣+H2O
CH2Br﹣COO﹣+H2O
D.用氢氟酸在玻璃上“刻字”:SiO2+4H++4F﹣=SiF4↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO﹣被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出.本实验所用的仪器及导管如图1所示. 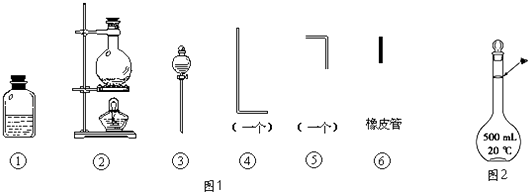
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为(填写图中编号).
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 .
(3)仪器①的橡皮塞上至少应有2个孔的原因是 .
(4)本实验需配置10molL﹣1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有(填仪器名称),定容时操作如图2,则所配溶液浓度(填“偏高”或“偏低”).
(5)实验时仪器①中ClO﹣与H2O2反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有密度为1.8g/m3、质簠分数为98%的“化学纯”硫酸.
(1)取该浓硫酸1L加蒸馏水稀释至18L,稀释后硫酸的物质的量浓度为
(2)现有Na2CO3、NaHCO3组成的混合物,加热到质量不再减少为止,放出标准状况下气体2.24L,取稀释后硫酸200mL恰好与剩余的残渣完全反应,又放出标准状况下气体AL,试计算①原混合物的质量
②原混合物Na2CO3与NaHCO3物质的量之比
③A= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com