
【题目】固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( ) 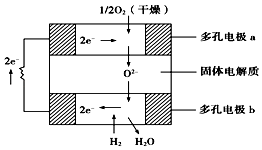
A.有O2参加反应的a极为电池的负极
B.b极的电极反应式为H2+O2﹣﹣2e﹣═H2O
C.a极对应的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.氧化锆的作用是让电子在电池内部通过
科目:高中化学 来源: 题型:
【题目】如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( ) 
A.2:2:4:1
B.1:1:2:1
C.2:1:l:1
D.2:2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)乙醇沸点是78℃,能与水以任意比例混溶.乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧.实验室制乙醚的反应原理是:2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O ①反应中应加入沸石,其作用是;
CH3CH2OCH2CH3+H2O ①反应中应加入沸石,其作用是;
②反应中温度计的位置是;
③该装置制得乙醚中可能含有大量的副产物乙烯,化学方程式: .
(2).苯和甲烷是两类烃的代表物质,回答下列问题: ①苯在常温常压下呈态.
②苯和甲烷中含碳量较高的是 .
③写出甲烷在氧气中燃烧的化学方程式 . 若将等物质的量的苯和甲烷分别燃烧,耗氧量较大的是 .
④写出苯与溴单质反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)把盛满NO2和O2的混合气体的试管倒立于水中.
①若一段时间内水上升且充满试管,则原混合气体中NO2和O2的体积比是 , 若假设生成的溶质不向外扩散,且为标准状况.则所得溶液的物质的量浓度应为 . (保留二位有效数字)
②若一段时间后上升的水只升到试管容积的一半,则剩余的气体为(用化学式表示).原混合气体中,NO2和O2的体积比是 .
(2)二氧化氮和氨气在一定条件下,充分反应,得到非常稳定的产物,其化学方程式为:6NO2+8NH3=7N2+12H2O,若20mlNO2和NH3的混合气体在一定条件下发生上述反应,已知实际参加反应的NO2比NH3少2mL,则原混合气体中NO2和NH3的物质的量之比可能为
A.3:4
B.3:2
C.1:2
D.3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 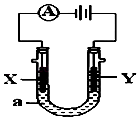
(1)若X,Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为 . 在X极附近观察到的现象是:
检验Y电极产物的方法是:
②电解总反应离子方程式为 .
(2)若X和Y仍均为惰性电极,a为CuSO 4 溶液,则电解时的化学反应方程式为
. 通过一段时间后,向所得溶液中加入16g CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极的电极反应式是(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,A,B中的电极为多孔的惰性电极;C,D为夹在湿的Na2SO4滤纸条中心的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1 , 闭合K2、K3通直流电,则:①标出电源的正、负极,a为极,b为极.
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 .
③写出电极反应式:
A中 .
B中 .
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3 , 闭合K1 , 则电流表的指针是否移动(填是或否) . 若电流表指针不移动说明理由,若指针移动也说明理由 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸或稀盐酸中,观察产生气泡的快慢,据此确定它们的活动性.该原理的离子方程式为 .
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性.试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,
并写出电极反应式.正极反应式:;负极反应式:;
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案与方案Ⅰ、Ⅱ不能雷同: , 用离子方程式表示其反应原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)![]() 2H2S(g)K 1 △H1 (1)
2H2S(g)K 1 △H1 (1)
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 △H2(2)
2H2O(g)+H2(g)K2 △H2(2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)的△H=________。
S2(g)+4H2O(g)的△H=________。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08molL-1min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为_______(填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8molH2、1.2molS2,建立平衡时测得S2的转化率为25%,据此判断△H1________0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________(写出主要反应的离子方程式),该溶液中,[Na+]________2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数=________molL-1。
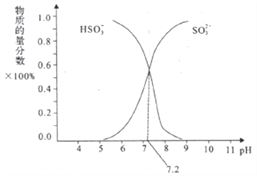
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com