
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
�����������������С��ȵ���Ƭ��ͭƬ���ֱ�ͬʱ����ϡ�����ϡ�����У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԣ���ԭ�������ӷ���ʽΪ ��
��������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԣ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ��
��д���缫��Ӧʽ��������Ӧʽ����������Ӧʽ����
�����������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽���뷽��������ͬ�� �� �����ӷ���ʽ��ʾ�䷴Ӧԭ���� ��
���𰸡�Fe+2H+�TFe2++H2����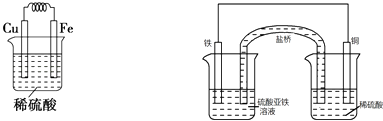 ��2H++2e��=H2����Fe=Fe2++2e����ȡ������������CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe+Cu2+�TCu+Fe2+
��2H++2e��=H2����Fe=Fe2++2e����ȡ������������CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe+Cu2+�TCu+Fe2+
���������⣺����������ϡ���ᷴӦ�����������������������ӷ���ʽΪFe+2H+�TFe2++H2�����ʴ�Ϊ��Fe+2H+�TFe2++H2����
����������Fe��Cu���缫��Ƴ�ԭ��أ�������ͭ���ã�����Ϊ��������Ϊͭ���������Һ��Ϊ���ͭ����Һ�������װ��ͼΪ 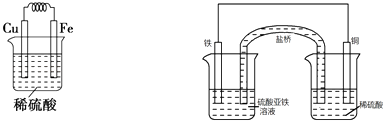 ������������������Fe2+ �� ����H+����ԭ����H2 �� ������ӦΪ2H++2e����H2����������ӦΪ
������������������Fe2+ �� ����H+����ԭ����H2 �� ������ӦΪ2H++2e����H2����������ӦΪ
Fe=Fe2++2e�� ��
�ʴ�Ϊ��  ��2H++2e��=H2����Fe=Fe2++2e����
��2H++2e��=H2����Fe=Fe2++2e����
������������ͭ���û���Ӧ��ƣ���Ʒ������£�����Ƭ����CuSO4��Һ�У�һ��ʱ���۲�Fe�����к�ɫ�Ľ���ͭ������������֤���������Ļ�����ǿ�ڽ���ͭ�ģ���Ӧԭ��Ϊ����ͭ���ӷ���������ԭ��Ӧ����ͭ�Ͷ��������ӣ���Ӧ�����ӷ���ʽΪFe+Cu2+�TFe2++Cu��
�ʴ�Ϊ��ȡ������������CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe+Cu2+�TCu+Fe2+ ��
����������ķ�Ӧ������д�����ӷ���ʽ��
������Fe��Cu���缫��Ƴ�ԭ��أ�������ͭ���ã�����Ϊ��������Ϊͭ���������Һ��Ϊ���ͭ����Һ��
��������֮ͭ����û���Ӧ��ƣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ1.43gNa2CO3xH2O����ˮ���10mL��Һ��Ȼ����ε���ϡ����ֱ��û������ų�Ϊֹ����ȥ����2.0mL�����ռ���112mL CO2����״�������Լ��㣺
��1��CO2�����ʵ���
��2��Na2CO3xH2O�����ʵ�����
��3��x��ֵ��
��4������ϡ��������ʵ�Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�����Թ�������ﯩ�������Ϊ����ʣ����ֹ��������ڸ��������������ӣ�O2���������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ���ǣ� �� 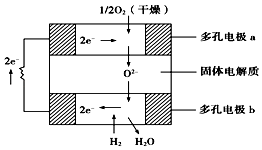
A.��O2�μӷ�Ӧ��a��Ϊ��صĸ���
B.b���ĵ缫��ӦʽΪH2+O2����2e���TH2O
C.a����Ӧ�ĵ缫��ӦʽΪO2+2H2O+4e���T4OH��
D.����ﯵ��������õ����ڵ���ڲ�ͨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������1000mL1mol/LNaCl��Һ����������²��裺�ټ��㣺��Ҫ������NaCl����
�ڳ�����������������壮
���ܽ⣺�������õ�NaCl���嵹���ձ��м�ˮ�ܽ⣬���ָ������£�
��ת�ƣ����ձ��е���Һ�ò���������ת�����У�
��ϴ�ӣ�������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ת��������ƿ �����û�н�ϴ��Һת��������ƿ��������Һ��Ũ�Ƚ�����ƫ���ƫС��
����ҡ��������ҡ����ƿ��ʹ��Һ��Ͼ���
�߶��ݣ�������ƿ�м�ˮ������̶���1��2���״���������
��ˮ����Һ��Һ����̶������У�
��ҡ�ȣ����µߵ�ҡ�ȣ�ʹ��Һ��Ͼ���
��װƿ��ǩ�������ƺõ���Һת�Ƶ��Լ�ƿ�У����ϱ�ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȲΪԭ����ȡCHClBr��CH2Br�����з���������е���( )
A.����HBr�ӳɺ�����HCl�ӳ�
B.����H2��ȫ�ӳɺ�����Cl2��Br2ȡ��
C.����HCl�ӳɺ�����Br2�ӳ�
D.����Cl2�ӳɺ�����HBr�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ӦN2��g��+3H2��g��2NH3��g����10L���ܱ������н��У����2min��N2�����ʵ�����20mol��С��8mol����2min����NH3��ʾ�ķ�Ӧ����Ϊ�� ��
A.1.2mol/��Lmin��
B.6.0mol/��Lmin��
C.0.6mol/��Lmin��
D.0.4mol/��Lmin��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2(aq)+I-(aq)һI3-(aq),ijI2��KI�����Һ�У�I3-�����ʵ���Ũ��c(I3-)���¶�T�Ĺ�ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ���ǣ� ��
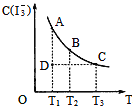
A. ��ӦI2(aq)+I-(aq)=I3-(aq)��H<0
B. ���¶�ΪT1��T2��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2,��K1>K2
C. ����Ӧ���е�״̬Dʱ��һ����v��>v��
D. ״̬A��״̬B��ȣ�״̬A��c(I2)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������R�����ڰ�����H2���һ��ϲ�������ը���������ж���ȷ���ǣ� �� 
A.�ǽ����ԣ�Z��T��X
B.R��Qԭ�Ӻ�����������26
C.��̬�⻯���ȶ��ԣ�R��T��Q
D.����������ˮ��������ԣ�X��T
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������õ���ͨ���Ũ��NaOH��H2O2�Ļ��Һ�У��ڵ��ܿ�����Һ�ĽӴ�������˸�ĺ����֣�������Ϊͨ������Һ�в�����ClO����H2O2��ԭ���������ҷ�Ӧ�����������ϸߵ������ӣ�Ȼ������ת��Ϊ��ͨ�����ӣ�����������Ժ��ų�����ʵ�����õ�������������ͼ1��ʾ�� 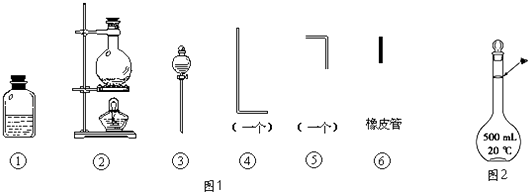
����Ҫ����д���пհף�
��1����װ��������װ��ʱ��Ӧѡ�õ�����������Ϊ����дͼ�б�ţ���
��2����ʵ�����ʱ����������������ҵ�˳�����������ĸ����������ܵı������Ϊ ��
��3�������ٵ���Ƥ��������Ӧ��2����ԭ���� ��
��4����ʵ��������10molL��1��NaOH��Һ500mL���õ�����������������ƽ���ձ��⣬�����õ��������������������ƣ�������ʱ������ͼ2����������ҺŨ�����ƫ�ߡ���ƫ�͡�����
��5��ʵ��ʱ��������ClO����H2O2��Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com