
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2(aq)+I-(aq)һI3-(aq),ijI2��KI�����Һ�У�I3-�����ʵ���Ũ��c(I3-)���¶�T�Ĺ�ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ���ǣ� ��
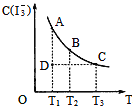
A. ��ӦI2(aq)+I-(aq)=I3-(aq)��H<0
B. ���¶�ΪT1��T2��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2,��K1>K2
C. ����Ӧ���е�״̬Dʱ��һ����v��>v��
D. ״̬A��״̬B��ȣ�״̬A��c(I2)��
���𰸡�D
����������������������¶ȵIJ������ߣ�I3-��Ũ���ļ�С��˵����Ӧ���淽���ƶ���I2��aq��+I-��aq��![]() I3-��aq����һ�����ȷ�Ӧ������H��0����A��ȷ��B����ΪK=
I3-��aq����һ�����ȷ�Ӧ������H��0����A��ȷ��B����ΪK=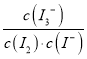 T2��T1�����Ե��¶�����ʱ����Ӧ���淽���ƶ�����K1��K2����B��ȷ��C����ͼ�п��Կ���D�㲢û�дﵽƽ��״̬��������Ҫ��A���ƶ���I3-��Ũ��Ӧ���ӣ�ƽ�����������ƶ�������v����v������C��ȷ��D���¶����ߣ�ƽ�����淽���ƶ���c��I3-����С����c��I2��Ӧ�������״̬B��c��I2����D����
T2��T1�����Ե��¶�����ʱ����Ӧ���淽���ƶ�����K1��K2����B��ȷ��C����ͼ�п��Կ���D�㲢û�дﵽƽ��״̬��������Ҫ��A���ƶ���I3-��Ũ��Ӧ���ӣ�ƽ�����������ƶ�������v����v������C��ȷ��D���¶����ߣ�ƽ�����淽���ƶ���c��I3-����С����c��I2��Ӧ�������״̬B��c��I2����D����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
��1���Ҵ��е���78�棬����ˮ������������ܣ����ѵķе�Ϊ34.6�棬������ˮ���ڱ���Na2CO3��Һ�м������ܣ����Ѽ���ȼ�գ�ʵ���������ѵķ�Ӧԭ���ǣ�2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O �ٷ�Ӧ��Ӧ�����ʯ������������
CH3CH2OCH2CH3+H2O �ٷ�Ӧ��Ӧ�����ʯ������������
�ڷ�Ӧ���¶ȼƵ�λ������
�۸�װ���Ƶ������п��ܺ��д����ĸ�������ϩ����ѧ����ʽ�� ��
��2�������ͼ������������Ĵ������ʣ��ش��������⣺ �ٱ��ڳ��³�ѹ�³�̬��
�ڱ��ͼ����к�̼���ϸߵ��� ��
��д��������������ȼ�յĻ�ѧ����ʽ �� ���������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ���� ��
��д�������嵥�ʷ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�A��B�еĵ缫Ϊ��Ķ��Ե缫��C��DΪ����ʪ��Na2SO4��ֽ�����ĵIJ��У���Դ��a��b����������A��B�г���KOH��Һ������KOH��Һ��ˮ���У��ж�K1 �� �պ�K2��K3ֱͨ���磬�ٱ����Դ������������aΪ����bΪ����
����ʪ��Na2SO4��Һ��ֽ�����ĵ�KMnO4Һ�Σ���ʲô���� ��
��д���缫��Ӧʽ��
A�� ��
B�� ��
�������һ��ʱ���A��B�о��������Χ�缫����ʱ�ж�K2��K3 �� �պ�K1 �� ���������ָ���Ƿ��ƶ������ǻ�� �� ��������ָ�벻�ƶ�˵�����ɣ���ָ���ƶ�Ҳ˵������ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
�����������������С��ȵ���Ƭ��ͭƬ���ֱ�ͬʱ����ϡ�����ϡ�����У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԣ���ԭ�������ӷ���ʽΪ ��
��������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԣ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ��
��д���缫��Ӧʽ��������Ӧʽ����������Ӧʽ����
�����������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽���뷽��������ͬ�� �� �����ӷ���ʽ��ʾ�䷴Ӧԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ�����£�C2H8N2����һ�ָ���ȼ�ϣ�ȼ�ղ����ľ���������Ϊ�������ػ�����ƶ���������������ȷ���ǣ� ��
A.ƫ�����µ�Ħ������Ϊ60g
B.6.02��1023��ƫ�����·��ӵ�����ԼΪ60g
C.1molƫ�����µ�����Ϊ60g/mol
D.6gƫ�����º���1.2NA��ƫ�����·���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ����˵����ȷ����
A. ��������������������
B. ʧȥ���ӣ����ϼ۽��͵������ǻ�ԭ��
C. ��ԭ������ԭ��������������
D. �õ����ӣ����ϼ۽��͵ķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ص�������ȷ���ǣ� ��
A.ϡ��Ũ����ʱ��Ӧ������ˮ���ձ��ڱڻ�����ע��Ũ�����в����Ͻ���
B.������Һʱ������ˮ��������ƿ�̶ȣ�Ӧ�ý�ͷ�ιܽ�������Һ����
C.����1molL��1 300mL NaCl��Һ����ѡ��һ��50mL������ƿ��һ��250mL������ƿ
D.��������ͼװ�ý���������β������ 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪I��II��Ӧ��һ���������ʱ估ƽ�ⳣ�����£�
2H2(g)+S2(g)![]() 2H2S(g)K 1 ��H1 ��1��
2H2S(g)K 1 ��H1 ��1��
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 ��H2��2��
2H2O(g)+H2(g)K2 ��H2��2��
��1������Hl����H2��ʾ��Ӧ4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)����H=________��
S2(g)+4H2O(g)����H=________��
��2���ش����з�Ӧ��1����������⣺
���¶�ΪT1����1L���������м���1.8molH2��1.2molS2��l0minʱ��Ӧ�ﵽƽ�⣮��ʱ���l0min��V��H2S��=0.08molL-1min-l������ʱ���������г���H2��S2��H2S��0.8mol����ƽ���ƶ�����Ϊ_______�����������������������������ƶ�������
���¶�ΪT2ʱ��T2��Tl������1L����������Ҳ����1.8molH2��1.2molS2������ƽ��ʱ���S2��ת����Ϊ25%���ݴ��ж���H1________0����������������������
��3�������£���SO2��NaOH��Һ��Ӧ�ɵõ�NaHSO3��Na2SO3�ȡ�
����֪Na2SO3ˮ��Һ�Լ��ԣ�ԭ����________��д����Ҫ��Ӧ�����ӷ���ʽ��������Һ�У�[Na+]________2[SO32-]+[HSO3-]����������������������=��������
����ijNaHSO3��Na2SO3�����Һ��HSO3-��SO32-���ʵ���������pH�仯������ͼ��ʾ�����֣�������ͼʾ����SO32-��ˮ��ƽ�ⳣ��=________molL-1��
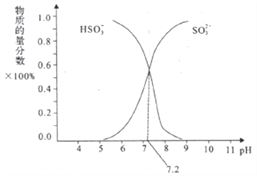
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ�����Ӧ���͵Ĺ�ϵ��ͼ��ʾ�����л�ѧ��Ӧ�в���������3�Ļ�ѧ��Ӧ�ǣ� �� 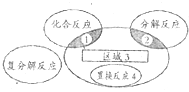
A.Br2+SO2+2H2O�TH2SO4+2HBr
B.CuO+CO ![]() Cu+CO2
Cu+CO2
C.4NH3+5O2�T4NO+6H2O
D.3Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com