
【题目】实验室有密度为1.8g/m3、质簠分数为98%的“化学纯”硫酸.
(1)取该浓硫酸1L加蒸馏水稀释至18L,稀释后硫酸的物质的量浓度为
(2)现有Na2CO3、NaHCO3组成的混合物,加热到质量不再减少为止,放出标准状况下气体2.24L,取稀释后硫酸200mL恰好与剩余的残渣完全反应,又放出标准状况下气体AL,试计算①原混合物的质量
②原混合物Na2CO3与NaHCO3物质的量之比
③A= .
【答案】
(1)1mol/L
(2)27.4g;1:2;4.48L
【解析】解:(1)密度为1.8g/m3、质簠分数为98%的“化学纯”硫酸的浓度为:c= ![]() mol/L=18mol/L,取该浓硫酸1L加蒸馏水稀释至18L,稀释过程中硫酸的浓度不变,则稀释后硫酸的物质的量浓度为:
mol/L=18mol/L,取该浓硫酸1L加蒸馏水稀释至18L,稀释过程中硫酸的浓度不变,则稀释后硫酸的物质的量浓度为: ![]() =1mol/L,所以答案是:1mol/L;(2)①标准状况下2.24L二氧化碳的物质的量为:
=1mol/L,所以答案是:1mol/L;(2)①标准状况下2.24L二氧化碳的物质的量为: ![]() =0.1mol,根据反应2NaHCO3
=0.1mol,根据反应2NaHCO3 ![]() Na2CO3+CO2↑+H2O可知原混合物中碳酸氢钠的物质的量为:0.1mol×2=0.2mol, 取稀释后硫酸200mL恰好与剩余的残渣完全反应,反应后溶质为硫酸钠,200mL 1mol/L的硫酸溶液中含有硫酸的物质的量为:1mol/L×0.2L=0.2mol,则反应后生成硫酸钠的物质的量为0.2mol,根据钠离子守恒可知残渣中含有碳酸钠的物质的量为0.2mol,则原混合物中含有碳酸钠的物质的量为:0.2mol﹣0.1mol=0.1mol,
Na2CO3+CO2↑+H2O可知原混合物中碳酸氢钠的物质的量为:0.1mol×2=0.2mol, 取稀释后硫酸200mL恰好与剩余的残渣完全反应,反应后溶质为硫酸钠,200mL 1mol/L的硫酸溶液中含有硫酸的物质的量为:1mol/L×0.2L=0.2mol,则反应后生成硫酸钠的物质的量为0.2mol,根据钠离子守恒可知残渣中含有碳酸钠的物质的量为0.2mol,则原混合物中含有碳酸钠的物质的量为:0.2mol﹣0.1mol=0.1mol,
所以原混合物的质量为:106g/mol×0.1mol+84g/mol×0.2mol=27.4g,
所以答案是:27.4g;②原混合物Na2CO3与NaHCO3物质的量之比为:0.1mol:0.2mol=1:2,
所以答案是:1:2;③残渣中含有碳酸钠的物质的量为0.2mol,根据碳原子守恒可知生成二氧化碳的物质的量为0.2mol,则生成标准状况下二氧化碳的体积为:22.4L/mol×0.2mol=4.48L,所以答案是:4.48L.


科目:高中化学 来源: 题型:
【题目】已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)![]() 2H2S(g)K 1 △H1 (1)
2H2S(g)K 1 △H1 (1)
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 △H2(2)
2H2O(g)+H2(g)K2 △H2(2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)的△H=________。
S2(g)+4H2O(g)的△H=________。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08molL-1min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为_______(填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8molH2、1.2molS2,建立平衡时测得S2的转化率为25%,据此判断△H1________0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________(写出主要反应的离子方程式),该溶液中,[Na+]________2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
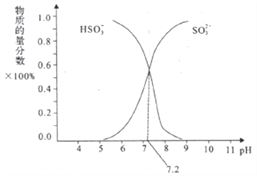
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数=________molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中不属于区域3的化学反应是( ) 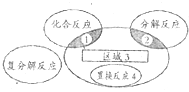
A.Br2+SO2+2H2O═H2SO4+2HBr
B.CuO+CO ![]() Cu+CO2
Cu+CO2
C.4NH3+5O2═4NO+6H2O
D.3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。下列关于1mol O2—的说法正确的是 ( )
A. 摩尔质量为64g B. 含16 mol质子
C. 含有1 mol电子 D. 最外层有8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 1摩尔任何集体都含有6.02×1023个分子
D. 1mol氧含6.02×1023个O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,选择最简便的实验方案有( )
A.通过NaOH后,通过浓H2SO4 , 再通过石灰水
B.通过CuSO4溶液后再通过石灰水
C.通过五氧化磷,再通过无水CaCl2
D.通过足量的碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在Ba(OH)2溶液中,c(Ba2+)=2c(OH-)
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.煤的气化和液化均属于化学变化
D.强电解质和弱电解质的划分依据是电解质水溶液的导电能力强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) 
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com