
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
(制备FeBr2固体)
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600—700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100—120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。
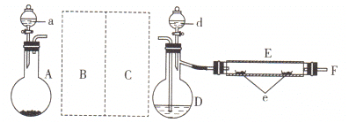
(1)若在A中盛固体CaCO3,a中盛有6 mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中装有的试剂分别是:B中为____________,C中为_________。若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为__________。
(2)E管中的反应开始后持续通入CO2的主要作用是______________。
(探究FeBr2的还原性)
(3)已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br-,也能氧化Fe2+。取10 mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+_________Br-(填“>”或“<”)。
(4)若在40 mL上述FeBr2溶液中通入标准状况下67.2 mL的C12,取少量反应后的溶液加入CCl4,振荡后下层液体呈_______色,写出该反应的离子方程式______。
【答案】饱和NaHCO3溶液 浓硫酸 3Fe+4H2O![]() Fe3O4+4H2↑ 将溴蒸气带入E装置中进行反应 > 橙红 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
Fe3O4+4H2↑ 将溴蒸气带入E装置中进行反应 > 橙红 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
【解析】
制备溴化亚铁主要是防止空气中的氧气氧化,因此整个装置要处于无氧的状态,实验室制备二氧化碳过程中有HCl气体和水蒸气杂质,因此要除掉这些杂质再利用二氧化碳带出溴蒸汽进入到E装置中发生反应。
通过实验先加少量氯气得出亚铁离子和溴离子的还原性,利用量的关系来进行书写溴化亚铁与氯气的反应离子方程式。
⑴若在A中盛固体CaCO3,a中盛有6 mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中装有的试剂分别是:
A中生成的二氧化碳,从A中出来的气体主要是二氧化碳气体,还有水蒸气和HCl气体,B中主要是除掉HCl气体,用饱和碳酸氢钠溶液,C中主要是除掉水蒸气,用浓硫酸干燥,若进入E装置中的CO2未干燥,水和铁粉再高温下反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O![]() Fe3O4+4H2↑,
Fe3O4+4H2↑,
故答案为:饱和NaHCO3溶液;浓硫酸;3Fe+4H2O![]() Fe3O4+4H2↑;
Fe3O4+4H2↑;
⑵在反应前CO2主要作用是排除装置内的空气,滴入液溴后CO2主要是将D中的液溴变为溴蒸汽进入到E管中与铁进行反应并在反应开始后持续通入CO2,
故答案为:将溴蒸气带入E装置中进行反应;
⑶取10 mL0.1mol/L FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色,说明溶液反应生成了铁离子,另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体,说明没有生成溴单质,因此还原性:Fe2+ > Br-,
故答案是:>;
⑷若在40 mL上述FeBr2溶液物质的量为0.004 mol,还原性Fe2+ > Br-,溶液中通入标准状况下67.2 mL的C12,物质的量为0.003 mol,
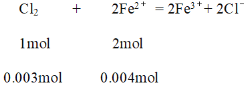
根据方程,氯气过量,应该按亚铁离子物质的量进行计算消耗氯气物质的量为0.002 mol,剩余0.001mol氯气与溴离子反应,
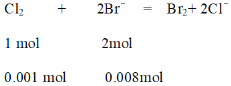
根据方程式得出消耗溴离子为0.002 mol,生成0.001 mol溴单质,因此取少量反应后的溶液加入CCl4,振荡后下层液体橙红色,
反应的离子方程式4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
故答案为:橙红;4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。


科目:高中化学 来源: 题型:
【题目】已知下列有机物: ①CH3—CH2—CH2—CH3和 ![]() ②CH2=CH—CH2—CH3和CH3— CH=CH—CH3
②CH2=CH—CH2—CH3和CH3— CH=CH—CH3
③CH3—CH2—OH和CH3—O—CH3④ 和
和 ⑤CH3—CH2—CH=CH—CH3和
⑤CH3—CH2—CH=CH—CH3和 ![]() ⑥CH2=CH
⑥CH2=CH
—CH=CH2和CH3—CH2—C≡CH。
(1)其中属于同分异构体的是________________。
(2)其中属于碳链异构体的是________________。
(3)其中属于官能团位置异构的是________________。
(4)其中属于官能团类型异构的是________________。
(5)其中属于同一种物质的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )

A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
①属于盐的是________(填序号),写出这种物质在水溶液中的电离方程式__________。
②上述物质中有一种与其他三种物质均能反应,此物质是__________(填序号)。
(2)酸性条件下,次磷酸(H3PO2)可发生下列反应而用于化学镀银。
口Ag++口H3PO2+口 =口Ag+口H3PO4+口
试回答下列问题
①该反应的氧化产物是_________。
②请将反应物和生成物补充完整并配平,并用双线桥法标出电子转移的数目。______
③若反应中生成10.8gAg,则转移电子的数目约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为_______
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是_____。
(3)过渡金属可形成许多羧基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、_______等(任写一个)。
②CO作配体时,配位原子是C而不是O,其原因是________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A [V(H2O)6]2+ B [V(CN)6]4- C [V(CO)6]- D [V(O2)4]3-
②化合物 的熔点为138℃,其晶体类型为________。
的熔点为138℃,其晶体类型为________。
(5)VCl2(熔点1027℃)和VBr2(熔点827℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是_________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备Cl2通常采用如图所示装置:

(1)A装置中发生反应的化学方程式是________;其中氧化剂是_________,每生成1 mol Cl2,被氧化的物质的物质的量是_____mol。
(2)仪器a的名称是_________;
(3)B装置中所盛的试剂是________________,装置C的作用是________________;
(4)若将下图集气瓶中充满饱和食盐水,代替装置D收集氯气,此时应气体从_______口流入(填“A”或“B”)。
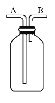
(5)E装置中发生反应的化学方程式是________________________。
(6)将下图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。
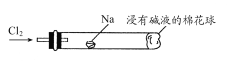
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C.玻璃管中,钠燃烧时会产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com