
【题目】如图所示,若电解5min时,测得铜电极的质量增加2.16g,试回答:
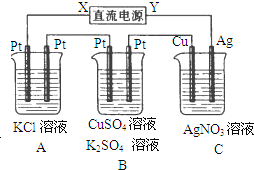
(1)电源中X电极是______(填“正”或“负”)极。
(2)通电5min,时,B中收集到224mL(标准状况下)气体,溶液体积为200mL,(电解前后溶液的体积变化忽略不计)则通电前c(CuSO4)=______。
(3)若A中KCl溶液的体积也是200mL,则电解后溶液的pH=______。
【答案】负 0.025mol/L 13
【解析】
(1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)根据电极反应及电子守恒来计算;
(3)根据A的电极反应式,结合C中电子转移数目相等计算A中c(OH-),通过水的离子积常数计算出c(H+),根据pH=-lgc(H+)得到溶液的pH。
(1)由铜电极的质量增加,Cu电极发生反应:Ag++e-=Ag,则Cu电极为阴极,可知X为电源的负极。
(2)C中阴极反应为Ag++e-=Ag,n(Ag)=![]() =0.02mol,则转移的电子为0.02mol,
=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成O2的物质的量是0.005mol,其V(O2)=0.005mol×22.4L/mol=0.112L=112mL,在阴极发生反应2H++2e-=H2↑,生成H2的体积224mL-112mL=112mL,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-=Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=![]() =0.025mol/L。
=0.025mol/L。
(3)由A中发生2KCl+2H2O![]() 2KOH+H2↑+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=
2KOH+H2↑+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=![]() =0.1mol/L,根据水的离子积常数Kw=1×10-14,可知c(H+)=1×10-14÷0.1=1×10-13mol/L,所以溶液的pH=-lgc(H+)=-lg1×10-13=13。
=0.1mol/L,根据水的离子积常数Kw=1×10-14,可知c(H+)=1×10-14÷0.1=1×10-13mol/L,所以溶液的pH=-lgc(H+)=-lg1×10-13=13。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。
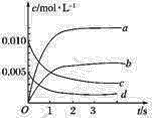
(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
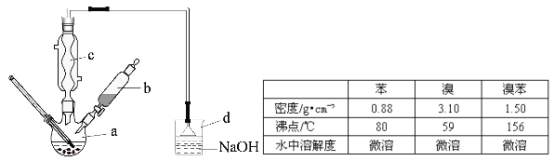
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式和化学方程式是学习化学的基本用语,请按要求书写:
(1)写出下列反应的离子方程式
①向石灰石滴加盐酸________________;
②硅酸钠溶液中滴加稀盐酸__________。
(2)写出下列离子反应方程式所对应的化学方程式
①![]() ________________;
________________;
②![]() ____________________
____________________
(3)写出稀硝酸与铜反应的化学方程式____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )
A. 该溶液物质的量浓度为10mol·L-1
B. 该溶液物质的量浓度因溶液的密度未知而无法求得
C. 该溶液中溶质的质量分数因溶液的密度未知而无法求得
D. 所得溶液的体积为22.5L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置图回答问题(装置图用符号表示):

(1)双氧水(H2O2)是无色液体,可发生如下化学反应:![]() 。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
(2)KClO3在MnO2作催化剂时,加热也可以制得氧气。应选用的气体发生装置是________。
(3)为了验证MnO2在KClO3分解过程中起到了催化剂作用,我们要把反应后的产物分离,提取出MnO2并验证其的确是催化剂。分离出MnO2的操作有________、________、洗涤、烘干、称量。为证明MnO2是催化剂,还需要知道的一个数据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜锌原电池中(如下图),

以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为_______________________________。锌片上观察到的现象为_______;
铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式是____;
铜片上观察到的现象是_______________,原电池总反应的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com