
����Ŀ����800��ʱ��2L�ܱ������ڷ�����Ӧ��2NO(g)��O2(g)2NO2(g)����Ӧ��ϵ�У�һ�����������ʵ�����ʱ��ı仯�����ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)��ͼ��ʾNO2�����ʵ���Ũ�ȱ仯��������________��
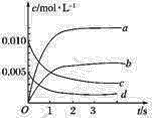
(2)��O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��
(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
A.v(NO2)��2v(O2)
B.������ѹǿ���ֲ���
C.������������������
D.�������ܶȱ��ֲ���
���𰸡�b 1.5��10��3mol��L��1��s��1 B
��������
��1����ͼ��������淴Ӧʱ����ӳ��������ʵ�Ũ�Ȳ��ٲ��䣬�ҷ�Ӧ��û����ȫ��Ӧ���ǿ��淴Ӧ������һ���������ʵ����ı仯֪���÷�Ӧ������Ӧ�����ƶ�����������������ʵ����ڲ���������ͬһʱ����ڣ�һ���������ٵ����ʵ������ڶ����������ӵ����ʵ�����
��2��������v=![]() ����һ�������ķ�Ӧ���ʣ��ٽ��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȼ��������ķ�Ӧ���ʣ�
����һ�������ķ�Ӧ���ʣ��ٽ��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȼ��������ķ�Ӧ���ʣ�
��3����ѧƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䡣
��1����ͼ��������淴Ӧʱ����ӳ��������ʵ�Ũ�Ȳ��ٲ��䣬�ҷ�Ӧ��û����ȫ��Ӧ�����Է�ӦΪ���淴Ӧ������һ���������ʵ����ı仯֪���÷�Ӧ������Ӧ�����ƶ�����������������ʵ����ڲ���������ͬһʱ����ڣ�һ���������ٵ����ʵ������ڶ����������ӵ����ʵ��������Ա�ʾNO2�ı仯��������b��
�ʴ�Ϊ��b��
��2��02s��v(NO)= ![]() =0.0030mol/(L.min)��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȣ����������ķ�Ӧ����Ϊ0.0015mol/(Ls)��
=0.0030mol/(L.min)��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȣ����������ķ�Ӧ����Ϊ0.0015mol/(Ls)��
�ʴ�Ϊ�� 0.0015mol/(Ls)��
��3��A.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�v(NO2)��2v(O2)Ϊ����Ӧ����֮�ȣ�����˵�����淴Ӧ������ͬ�����ж����淴Ӧ�����Ƿ���ȣ���A����
B.��Ӧǰ�����������ͬ��ѹǿ����˵�����淴Ӧ������ȣ������Ũ�Ȳ��䣬��B��ȷ��
C. ������������Ӧ�������ﶼ�������������䣬����˵����Ӧ�ﵽƽ��״̬����C����
D.������������Ӧ�������ﶼ�������������䣬������䣬�����ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����D����
��ѡB��
�ʴ�Ϊ��B��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������£�һ�ݻ�������ܱ��������������������Ļ�����壬��ȼǡ����ȫ��Ӧ�ָ���ԭ״̬��ѹǿ��Ϊԭ����![]() ������ԭ������������������������________��
������ԭ������������������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ����仯�����˵��������ȷ����
A.�����������ͷ�Ӧ��������ըҩ��������
B.�ȼҵ�п����ð�����������ܵ��Ƿ�й©
C.��ҵ���Ʊ�����������NH3��O2��Ӧ����NO����һ��ת��ΪNO2��HNO3
D.Ϊ�����������֣��������̬��������Է��ϻ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����������ƽ���ƶ�ԭ�����ǣ� ��
A. ����ơ������ĭ�ݳ�
B. ��FeCl3��Һ�м�KSCN����![]() Fe��SCN)3(Ѫ��ɫ)+3KCl��Ӧ��ƽ�������ϵ�м���KCl���壬ʹ��ϵ��ɫ��dz
Fe��SCN)3(Ѫ��ɫ)+3KCl��Ӧ��ƽ�������ϵ�м���KCl���壬ʹ��ϵ��ɫ��dz
C. װ��![]() ����ƿ������ˮ����ɫ����
����ƿ������ˮ����ɫ����
D. ʵ�������ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4molX�����0.6molY��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)+5Y(g) ![]() nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
��1��ǰ2min����W��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ_______________��
��2��2minĩʱY��Ũ��Ϊ_____________________________��
��3����ѧ��Ӧ����ʽ��n=_____________________________��
��4��2minĩ���ָ�����Ӧǰ�¶ȣ���ϵ��ѹǿ�Ƿ�Ӧǰѹǿ��__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4)��������ɱ�������ܾ�ˮ����һ�������ˮ����������ҵ ���Ʊ�������ص�һ�ֹ����������£�
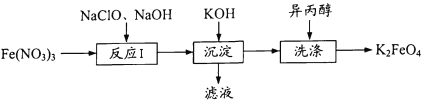
��1��K2FeO4����Ԫ�صĻ��ϼ�Ϊ ____��
��2�� ����ӦI���вμӷ�Ӧ��Fe3+��ClO-�����ʵ���֮��Ϊ2 : 3,����Һ�к������ʵĻ�ѧʽΪ____��д������ӦI�������ӷ���ʽ��_____��
��3��K2FeO4��ˮ�з�����Ӧ��4K2FeO4+ 10H2O = 4Fe(OH)3 �����壩+8KOH+3O2 �����������������ɱ������Ϊ____;���ܾ�ˮ����Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2H2(g)+CO(g)![]() CH3OH(g)��ƽ�ⳣ�����±���������ͬ�����ʵ���Ͷ�ϣ�
CH3OH(g)��ƽ�ⳣ�����±���������ͬ�����ʵ���Ͷ�ϣ�
���CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ�����д�С�Ƚ���ȷ����
ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
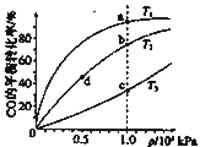
A.ƽ�᳣����K(a)��K(c)��K(b)=K(d)
B.����Ӧ���ʣ�v(a)��v(c)��v(b)=v(d)
C.�ﵽƽ������ʱ�䣺t(a)=t(c)��t(b)��t(d)
D.ƽ����Է���������M(a)=M(c)��M(b)��M(d)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.�ñ���Na2CO3��Һ����CaSO4���壺CO![]() +CaSO4
+CaSO4![]() CaCO3+SO
CaCO3+SO![]()
B.��NH4HCO3��Һ�м�������ʯ��ˮ��Ca2++HCO![]() +OH-=CaCO3��+H2O
+OH-=CaCO3��+H2O
C.��CuSO4��Һ�мӹ����İ�ˮ��Cu2++2NH3��H2O=Cu(OH)2��+2NH![]()
D.�õ⻯�ص�����Һ��������������NO![]() �Ĵ��ڣ�NO
�Ĵ��ڣ�NO![]() +2I-+2H+=NO��+I2+H2O
+2I-+2H+=NO��+I2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������5minʱ�����ͭ�缫����������2.16g���Իش�
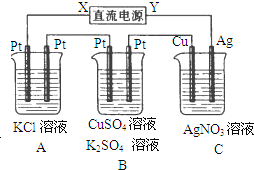
(1)��Դ��X�缫��______������������������������
(2)ͨ��5min��ʱ��B���ռ���224mL(��״����)���壬��Һ���Ϊ200mL�������ǰ����Һ������仯���Բ��ƣ���ͨ��ǰc(CuSO4)=______��
(3)��A��KCl��Һ�����Ҳ��200mL���������Һ��pH=______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com