
【题目】一定温度下,某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是( )
A.缩小反应体系的体积,化学反应速率加快
B.c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.0~15s内用I2表示的平均反应速率为v(I2)=0.002mol/(Ls)
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】蜂胶中含有某种活性物质X,其结构简式如图所示。下列关于X的说法错误的是
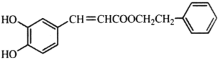
A.分子式为C17H16O4
B.不含手性碳原子,但具有顺反异构现象
C.与溴水既可发生加成反应又可发生取代反应
D.1mol X最多能与8mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟由“侯氏制碱法”制取Na2CO3,以下实验步骤能实现的是( )
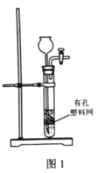

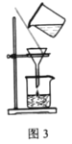
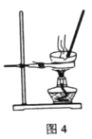
A.用图1装置由石灰石与稀盐酸制备CO2
B.用图2装置除去CO2中的HCl
C.用图3装置过滤所得的NaHCO3固体
D.用图4装置加热灼烧NaHCO3固体制Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
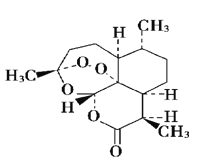
A. C8H10含苯环的烃同分异构体有3种
B. 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物
C. 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
D. 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取, 能够发生水解反应,具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
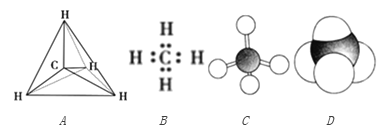
(1)甲烷的比例模型是________,甲烷的电子式是__________ (填序号)。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为100的烷烃的分子式是_______________。
(4)甲烷与丙烷互为________。
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(molL-1) | K1=5.6×10-2 K2=5.4×10-3 | K=1.7×10-5 | K=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)草酸(H2C2O4)是一种___(填“一元”、“二元”、“多元”)弱酸。25℃时,0.1molL-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是__。
(2)KHC2O4溶液呈酸性,向10mL0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液V(mL)。回答下列问题:
①当V<10mL时,反应的离子方程式为___。
②当V=10mL时,溶液中![]() 、
、![]() 、H2C2O4、H+的浓度由大到小的顺序为__。
、H2C2O4、H+的浓度由大到小的顺序为__。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(![]() )+c(
)+c(![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4);则a__b(填“<”“=”或“>”).
)+c(H2C2O4);则a__b(填“<”“=”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是危害性极强的毒性气体,也是恶臭气体的主要成分之一。![]() 菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
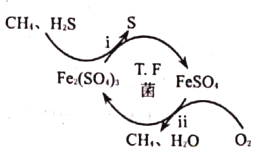
A.![]() 在脱硫过程中被还原
在脱硫过程中被还原
B.温度越高,越有利于天然气的催化脱硫
C.该脱硫过程需要不断添加![]() 溶液
溶液
D.理论上,需要氧气的体积是相同状态下![]() 体积的一半
体积的一半
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如下处理:

已知氯化铁溶液可用于腐蚀印刷电路铜板的离子反应为:Cu+2Fe3+=Cu2++2Fe2+
下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中氧元素的物质的量为0.03mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04mol
④V=224
⑤V=336
A.①③④B.②③④C.②③⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间使用大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
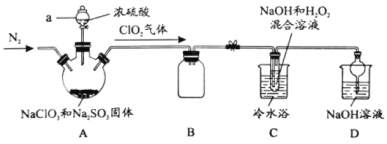
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称_________。
(2)装置A中发生反应的化学方程式:________。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是_______。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;③_________; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式________。
(6)实验结束后,继续通入一段时间N2的目的是________。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2![]() =
=![]() +2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
+2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com