
| A、1.08克 |
| B、1.44克 |
| C、1.8 克 |
| D、无法计算 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 3 |
| 54g×0.08mol |
| 3mol |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 应取浓硫酸的体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
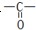 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能源 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、充分开发利用天然纤维,停止使用各种化学合成材料 |
| D、加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性溶液中:Na+、K+、SO32-、S2- |
| B、无色溶液中:Na+、Fe3+、Cl-、SO42- |
| C、无色溶液中:Na+、K+、HCO3-、AlO2- |
| D、酸性溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9g重水(D2O)中所含质子数为0.5×6.02×1023 |
| B、电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
| C、往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
| D、VL a mol?L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、②③⑤ |
| C、③④⑤ | D、②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com