
【题目】某二次电池充放电时总反应可表示为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
A.该电池可用H2SO4溶液作电解液
B.放电时,当有1molFe(OH)2生成时,电解质溶液中通过的电子数为2NA
C.放电时,Fe所在的电极发生还原反应
D.充电时,阳极的电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 由 图甲可知,a点Kw的数值比b点Kw的数值大
B. 乙表示在相同的密闭容器中,不同温度下的反应,该反应的ΔH<0
C. 丙表示0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1醋酸溶液的滴定曲线
D. 根据图丁,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可治疗各型高血压及作血管扩张剂,它的一种合成路线如下:
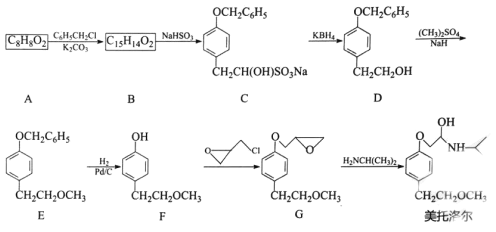
已知:![]() +
+![]()
![]()
![]() +HCl
+HCl
(1)A的化学名称是 _________,B的结构简式为__________,美托洛尔中含氧官能团的名称是_____________。
(2)A合成B的反应中,加人K2CO3的作用可能是 _________。
(3)B合成C的反应类型是________ 。
(4)F生成G的化学方程式为________ 。
(5)氯甲基环氧乙烷(![]() ) 是合成有机化合物的重要原料,实验室检验卤代烃中氯原子的常用试剂是______。
) 是合成有机化合物的重要原料,实验室检验卤代烃中氯原子的常用试剂是______。
(6)芳香族化合物M是F的同分异构体.则符合下列条件的M共有___种(不含立体异构)。
①苯环上只有2个取代基
②1molM与足量 Na 充分反应能生成1mol H2
③能与FeCl3溶液发生显色反应。
其中核磁共振氢谱为5组峰同分异构体的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
① 2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0 平衡常数为K1;
2ClNO(g) ΔH1<0 平衡常数为K1;
② 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应①达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=______mol,NO的转化率α1=______。
②其他条件保持不变,反应②升高温度,平衡时NO2的转化率_____((填“增大”“减小”或“不变”),平衡常数K2______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。


(1)仪器A的名称是_________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__________________。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的______ (填序号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积____(填序号)(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在NH4+、Cl-、H+、OH-四种离子。下列各离子浓度关系一定不正确的是( )
A.c(NH4+)+c(H+)=c(Cl-)+c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )

A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液的说法中正确的是
A.pH=7的溶液中,Na+、NH4+、CH3COO-、NO3-可以大量共存
B.Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9,任何条件下二者不可能相互转化
C.1mol/LNa2SO4溶液中阴离子数目大于1mol/LNa2CO3溶液中阴离子数目
D.Na2S溶液与FeC13溶液混合后产生沉淀,该沉淀一定是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com