
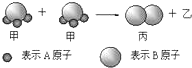
| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32-、 |
| B、c(H+)=1×10-13 mol?L-1的溶液中:Mg2+、Cu2+、NO3- |
| C、0.1 mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 键 | H-H | N≡N | O=O | F-F | H-Cl |
| 键能 | 436 | 946 | 498 | 157 | 431 |
| 键 | N-N | P-P | P-O | Cl-Cl | Br-Br |
| 键能 | 193 | 198 | 360 | 242.7 | 193 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 溶液中滴入少量盐酸:CO32-+H+═HCO3- |
| B、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、Ba(OH)2与稀H2SO4反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| D、FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40g SO2气体所占的体积为11.2L |
| B、7.1gCl2与足量水反应转移电子数为0.1NA |
| C、1mol?L-1的CH3COONa溶液中,CH3COO-离子数小于NA |
| D、常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.9×10-3mol |
| B、4.5×10-2mol |
| C、1.1×102mol |
| D、5.6×10mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com