
【题目】Co2O3常用于作氧化剂,在生产中有重要应用。
(1)一定条件下,0.996gCo2O3与15.00mL0.1mol·L-1的Na2S2O3溶液恰好完全反应,生成Co2+和一种含硫物质,该含硫物质中硫元素的化合价是___。
(2)Co2O3、PbO2、KMnO4均可与浓盐酸反应生成Cl2,同时分别生成Co2+、Pb2+和Mn2+。若生成等物质的量的Cl2,所需Co2O3、PbO2和KMnO4的物质的量之比为___。
(3)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co3+![]() Co2+、MnO
Co2+、MnO![]()
![]() Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___(写出计算过程)。
【答案】+6 5:5:2 83%
【解析】
(1)~(2)均体现Co2O3的氧化性,可通过得失电子数守恒求解;
(3) 可实验中加入的亚铁离子和Co2O3与KMnO4分别发生氧化还原反应,按消耗的0.0500mol·L-1KMnO4标准溶液的体积,计算出和它反应的亚铁离子的量,则另一部分亚铁离子被Co2O3氧化,按关系式即可计算出某Co2O3样品中Co2O3的纯度,据此回答;
(1)一定条件下,0.996gCo2O3的物质的量为![]() =0.006mol,则反应中Co2O3得到电子为0.006mol×2=0.012mol ,则15.00mL0.1mol·L-1的Na2S2O3溶液失去的电子为0.012mol ,1mol硫原子失去的电子为
=0.006mol,则反应中Co2O3得到电子为0.006mol×2=0.012mol ,则15.00mL0.1mol·L-1的Na2S2O3溶液失去的电子为0.012mol ,1mol硫原子失去的电子为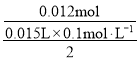 =4mol,则硫元素化合价升4价,所得产物中含硫物质中硫元素的化合价是+6;
=4mol,则硫元素化合价升4价,所得产物中含硫物质中硫元素的化合价是+6;
答案为:+6;
(2)Co2O3、PbO2、KMnO4均可与浓盐酸反应生成Cl2,同时分别生成Co2+、Pb2+和Mn2+。则反应关系式分别为:![]() 、
、![]() 和
和![]() ,因为生成等物质的量的Cl2,假设得5mol Cl2,则三个反应中转移电子10mol,所需Co2O3、PbO2和KMnO4的物质的量分别为5mol、5mol和2mol,则Co2O3、PbO2和KMnO4的物质的量之比为5:5:2;
,因为生成等物质的量的Cl2,假设得5mol Cl2,则三个反应中转移电子10mol,所需Co2O3、PbO2和KMnO4的物质的量分别为5mol、5mol和2mol,则Co2O3、PbO2和KMnO4的物质的量之比为5:5:2;
答案为:5:5:2;
(3)测定某Co2O3样品中Co2O3的纯度的实验中:步骤1: 2.000g样品在足量硫酸中溶解并和50mL0.5000mol·L-1FeSO4溶液充分反应,Co3+把亚铁离子氧化后亚铁离子还有剩余,步骤2中,多余的亚铁离子被20.00mL 0.0500mol·L-1KMnO4标准溶液反应完全,则
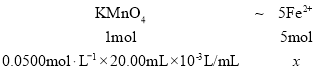 ,得x=0.00500mol ,
,得x=0.00500mol ,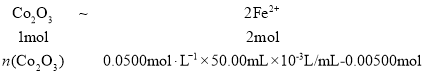 ,则
,则![]() =0.0100mol,
=0.0100mol,![]() =0.0100mol×166g/mol=1.66g,则Co2O3样品中Co2O3的纯度=
=0.0100mol×166g/mol=1.66g,则Co2O3样品中Co2O3的纯度=![]() =83%;
=83%;
答案为:83%。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】为了研究反应![]() 的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。
的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。

(1)所发生的反应________(填“放出”或“吸收”)热量。
(2)参加反应的A和B的总能量________(填“高于”或“低于”)生成的C和D的总能量。
(3)该反应中物质的化学能通过化学反应转化成________释放出来。
(4)该反应中,断裂反应物中化学键吸收的能量________(填“高于”或“低于”)形成生成物中化学键放出的能量。
(5)写出一个符合题中条件的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M具有抗氧化、抗肿瘤作用,其结构简式如图所示。下列有关M的说法正确的是( )
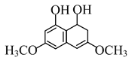
A.一定条件下M可发生加成、氧化、消去等反应
B.M与Na、NaOH溶液、NaHCO3溶液均能发生反应
C.1molM与浓溴水充分反应,最多消耗Br2的物质的量为4mol
D.M分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
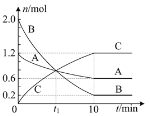
A.t1时刻反应达到平衡状态
B.0~10min内平均速率v(B)=0.18mol·L-1·min-1
C.该反应的化学方程式可表示为:A+3B![]() 2C
2C
D.该温度下,反应的平衡常数为1200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和原理,正确的是
①吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管;②往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2;③重结晶时,溶液冷却速度越慢得到的晶体颗粒越大;④可用水鉴别已烷、四氯化碳、乙醇三种无色液体;⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离;⑥加酶洗衣粉可用来洗涤棉织品、腈纶织品和涤纶织品;⑦硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物;⑧萃取时振荡的操作如图
![]()
A.②④⑧B.①③⑤C.③④⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
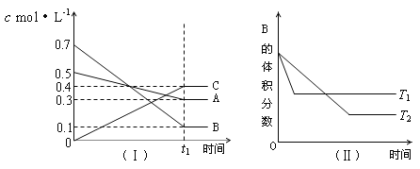
A.该平衡体系的化学反应方程式为:A(g)+B(g)![]() C(g)
C(g)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T1<T2
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关离子方程式书写正确的是![]()
A.![]() 溶液与少量的氢氧化钠溶液混合加热:
溶液与少量的氢氧化钠溶液混合加热:![]()
B.向![]() 溶液中加入过量的澄清石灰水:
溶液中加入过量的澄清石灰水:![]()
C.等物质的量的![]() 和
和![]() 在溶液中的反应:
在溶液中的反应:![]()
D.“84消毒液”和“洁厕灵”![]() 主要成分为盐酸
主要成分为盐酸![]() 混合使用会产生有毒气体:
混合使用会产生有毒气体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
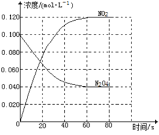
(1)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”“小于”),判断理由是___。
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com