
【题目】用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是
A. CuSO4 B. H2SO4 C. CuCl2 D. NaCl
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷) ![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
请回答下列问题
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25℃、101kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/ kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_______________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况能说明该反应达到平衡状态的是__________(填标号)
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率利乙烷消耗速率相等
②为了提高反应速率和反应物的转化率,可采收的措施是______________________________。
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________________________________________。

(4)在一定温度下向10L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烷的生成速率v(C2H6)=__________ mol·L-1·min-1
②上述条件下,正丁烷的平衡转化率为______________,该反应的平衡常数K为____________。 (5)丁烷一空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-=26CO32-,则负极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH固体试样中含有NaCl杂质,为测定NaOH的质量分数,进行了如下实验。
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加3~4滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:

请回答:
(1)步骤①中配制溶液时,需要的玻璃仪器除烧杯,胶头滴管,玻璃棒外,还需要 ____________。
(2)用______滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(3)烧碱样品的纯度为_______________。
(4)若出现下列情况,测定结果偏高的是______。
a.滴定前用蒸馏水冲洗锥形瓶
b.盛放标准液滴定管用蒸馏水洗后,未用标准液润洗
c. 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d. 在振荡锥形瓶时不慎将瓶内溶液溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应M+3N![]() 2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是
2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是
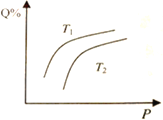
A. M和N不能都为气体
B. 由上图可知, N一定为气体
C. 若正反应方向ΔH>0,则T1<T2
D. 其它条件不变,压强增大,混合气体的平均相对分子质量减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com