
【题目】下列离子方程式不正确的是
A.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+=CaSO3↓
C.NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-![]() CO32-+NH3↑+2H2O
CO32-+NH3↑+2H2O
D.硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
科目:高中化学 来源: 题型:
【题目】将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况下)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(NaCl)=1.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A. Na与水反应时增大水的用量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温、恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生实验事实或结论均正确的是
选项 | 事实 | 结论 |
A | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
B |
| 记录滴定终点读数为12.20mL |
C | Mg(OH)2固体在溶液中存在平衡: Mg(OH)2(s) | 该固体不溶于NH4Cl溶液 |
D | 镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生同时测得溶液的pH为8.6 | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生,弱碱性溶液中OH- 氧化了Mg |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g/mL,沸点约55℃,分离水和丙酮时最合理的方法是( )
A.蒸发
B.分液
C.过滤
D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的 ZrO3固体,它在高温下能传导O2。下列说法正确的是
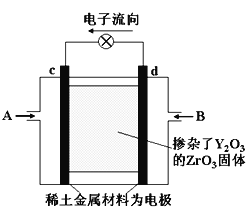
A.c电极名称为负极,气体A为空气
B.d电极上发生反应:CH4-8e-+4O2-=CO2+2H2O
C.O2向c电极移动
D.电池工作时,电子流动方向:d电极 → c电极 → d电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,反应N2(g)+3 H2(g) ![]() 2 NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为
2 NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol/L。若将容器的容积压缩为原来的
,N2与NH3的浓度均为c mol/L。若将容器的容积压缩为原来的![]() ,当达到新平衡时,下列说法中正确的是( )
,当达到新平衡时,下列说法中正确的是( )
A.新的平衡体系中,N2的浓度小于2 c mol/L大于c mol/L
B.新的平衡体系中,NH3的浓度小于2 c mol/L大于c mol/L
C.新的平衡体系中,混合气体的平均摩尔质量小于![]()
D.新的平衡体系中,气体的密度是原平衡体系的1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com