
【题目】Ⅰ.常温下,将除去表面氧化膜的Al、Cu片放入U形管作原电池的两极,测得图1所示原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
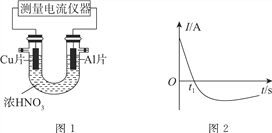
(1)0~t1时,原电池的负极是Al片,此时,正极的电极反应式是________。溶液中的H+向________(填“正”或“负”)极移动。
(2)t1时,原电池中电子流动方向发生改变,其原因是________。
Ⅱ.下图所示电化学装置中,a为足量的电解质溶液,X、Y是两块电极板。
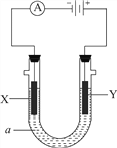
请回答:
(3)若X、Y都是石墨电极,a是含有酚酞的饱和NaCl溶液,则在X电极附近观察到的现象是________,检验Y电极上反应产物的化学方法及实验现象是________,电解池总反应的离子方程式为________。
【答案】 2H++NO3-+e-=NO2↑+H2O 正 Al在浓HNO3中发生钝化,形成的氧化膜阻止了Al的进一步反应 X电极上放出无色气体,附近溶液变为红色 把湿润的碘化钾淀粉试纸放在Y电极附近的U形管出口处,试纸变为蓝色 2C1-+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
【解析】(1)0~t1时,原电池的负极是Al片,溶液中产生红棕色气体是二氧化氮,故正极反应方程式为:2H++NO3-+e-=NO2↑+H2O,此时溶液中的氢离子移向正极;
(2)一段时间后,由于Al与浓硝酸发生钝化,导致原电池中Al作正极,Cu作负极,原电池中电子流动方向发生改变;
(3)X电极上氢离子放电,电极反应式为2H++2e-=H2↑,同时电极附近生成氢氧根离子,导致溶液碱性增强,溶液呈红色;Y电极上氯离子失电子发生氧化反应而生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的碘化钾淀粉试纸放在Y电极附近检验氯气,试纸变蓝色,电极反应式为2Cl--2e-=Cl2↑,电解一段时间之后溶液的PH将会升高,电池反应式为 2C1-+2H2O![]() 2OH+H2↑+Cl2↑。
2OH+H2↑+Cl2↑。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )

A. c点处正反应速率和逆反应速率相等
B. a点处正反应速率比b点处的大
C. d点(t1时刻)和e点(t2时刻)处n(N2)不同
D. t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
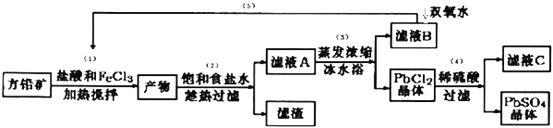
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了一套实验分馏原油的五个步骤:

①将仪器a固定在铁架台上,在仪器a上塞好带温度计的橡皮塞.
②连接好冷凝管.把冷凝管固定在铁架台上,将冷凝管进水口的橡皮管的一端和水龙头连接,出水口相接的橡皮管的另一端放在水槽中.
③把酒精灯放在铁架台上,调整铁圈的高度,放好石棉网.
④向仪器a中放入几片碎瓷片,再用漏斗向仪器a中加入原油,塞好带温度计的橡皮塞,把连接器连接在冷凝器的末端,并伸入接收装置(如锥形瓶)中.
⑤检查气密性(利用给固定装置微热的方法).请完成以下问题:
(1)上述实验正确的操作顺序是:______(填序号).
(2)仪器a的名称为:______.
(3)冷凝管里水流的方向为____进____出.(填f或g,注:上为f下为g).
(4)分馏原油是利用了原油中各组分的______不同而达到分离的目的.
(5)仪器a中放几片碎瓷片的目的是______.
(6)在实际工业生产中,除石油的分馏,人类利用煤炭的历史也很悠久,从煤焦油中能分离得到了一种重要化工原料“苯”,请写出该物质与浓硝酸反应的化学方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5]有机化学基础:有机物丙(C13H18O2)是一种香料.其可由甲和乙在浓硫酸催化作用和加热条件下合成:

已知以下信息.:
①甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰;
②乙为香醇的同系物.香醇的结构简式为:
③![]()
回答下列问题:
(1)A的名称为____________。
(2)B的分子式为______________。
(3)C与新制碱性Cu(OH)2反应的化学方程式为____________。
(4)丙中有两个甲基.在一定条件下,1 mol D可以和2 mol H2反应生成乙.D可以发生银镜反应.则D 的结构简式为____________。
(5)甲与乙反应的化学方程式为______________,该反应类型为_________________:
(6)甲的同分异构体中含有“COO”结构的共有_____________种(不包含甲),其中核磁共振氢谱为3组 峰。且峰面积之比为6:1:1的为______________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ⑥ | ④ | ⑤ | ⑦ | ⑩ | ⑧ | ⑨ |
⑴在这10种元素中,非金属性最强的元素是_____ (填“元素符号”);金属性最强的元素是_____(填“元素符号”);化学性质最不活泼的元素是_______(填“元素符号”);元素②简单离子的结构示意图为___________________。
⑵元素①与②中,原子半径较大的是________(填元素符号)。
⑶元素②与⑦的气态氢化物分别为__________和__________ (填化学式),两者的热稳定性大小为:前者_____后者。(填“>”、“<”或“=”)。
⑷元素④与⑧的最高价氧化物的水化物分别为______和______(填“化学式”),
两者反应的离子方程式为__________________________________。
⑸元素⑤的氧化物与盐酸反应的离子方程式为: _______________________。
⑹元素⑧的单质与元素⑩的氢化物反应的化学方程式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com