
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
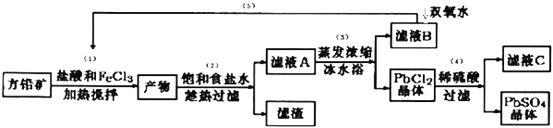
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
【答案】 抑制Fe3+的水解 2Fe3++PbS+2Cl-=PbCl2+S+2Fe2+ 用冰水浴使PbCl2(s)+2Cl-(aq) ![]() PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出 FeCl3、HCl PbCl2+SO42-= PbSO4+2Cl- 5×10-3 PbO2+4H++2Cl-=Pb2++Cl2+2H2O
PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出 FeCl3、HCl PbCl2+SO42-= PbSO4+2Cl- 5×10-3 PbO2+4H++2Cl-=Pb2++Cl2+2H2O
【解析】往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,有利于PbCl2(s)+2Cl-(aq)![]() PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl。
PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl。
(Ⅰ)Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7,流程中加入盐酸可以控制溶液的pH<1.9,主要目的是:抑制Fe3+的水解,FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,反应离子方程式为:2Fe3++PbS=PbCl2+S+2Fe2+;(Ⅱ)用冰水浴使PbCl2(s)+2Cl-(aq)![]() PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出;(Ⅲ)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用;(Ⅳ)①根据以上分析可知步骤(4)中反应的离子方程式为PbCl2+SO42-=PbSO4+2Cl-;当氯离子浓度小于10-5mol/L时可以认为沉淀完全,此时银离子浓度是2.0×10-10/10-5mol/L=2×10-5mol/L,所以铬酸钾的浓度是
PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出;(Ⅲ)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用;(Ⅳ)①根据以上分析可知步骤(4)中反应的离子方程式为PbCl2+SO42-=PbSO4+2Cl-;当氯离子浓度小于10-5mol/L时可以认为沉淀完全,此时银离子浓度是2.0×10-10/10-5mol/L=2×10-5mol/L,所以铬酸钾的浓度是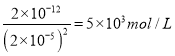 ;(Ⅴ)PbO2与MnO2性质相似,PbO2与浓盐酸加热条件下生成氯气的离子方程式为PbO2+4H++2Cl-
;(Ⅴ)PbO2与MnO2性质相似,PbO2与浓盐酸加热条件下生成氯气的离子方程式为PbO2+4H++2Cl-![]() Pb2++Cl2+2H2O。
Pb2++Cl2+2H2O。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6克X与Y完全反应后,生成4.4克R,则在此反应中Y和M的质量之比为( )
A.16:9
B.23:9
C.32:9
D.46:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①甲烷、②乙烷、③丙烷、④丁烷4种烷烃,试回答下列各题(填序号):
a.上述气态烃中,其一氯取代物的同分异构体只有两种的是____________。
b.等物质的量上述气态烃充分燃烧,消耗O2的量最多的是_____________。
c.等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是_________。
(2)有4种无色液态物质: a.1-己烯[CH3(CH2)3CH=CH2]、b.己烷[ CH3(CH2)4CH3]、
c.苯(![]() )、d.甲苯(
)、d.甲苯(![]() ),
),
请回答下列问题:
①能与溴水和酸性KMnO4溶液反应的是________________(写编号),
②不能与溴水反应但能与酸性KMnO4溶液反应的是________________(写编号)。
③不能与溴水和酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是________(写编号),反应的化学方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是( )
编组 | A | B | C | D |
强电解质 | NaCl | H2SO4 | CaCO3 | H2S |
弱电解质 | HF | BaSO4 | HClO | NH3·H2O |
非电解质 | Cl2 | CS2 | CH4 | 蔗糖 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学.下列与化学有关的说法,不正确的是( )
A.油条用的膨松剂中含有一种对人体危害很大的铝元素
B.用米汤检验加碘食盐中的碘酸钾(KIO3)
C.甲醇、多元醇、醛类、羧酸、酯类、酸类等也是组成酒的有机物
D.医学上用氢氧化铝用作胃酸中和剂,其主要原因在于它对肠胃温和不刺激
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将除去表面氧化膜的Al、Cu片放入U形管作原电池的两极,测得图1所示原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
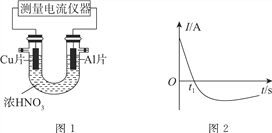
(1)0~t1时,原电池的负极是Al片,此时,正极的电极反应式是________。溶液中的H+向________(填“正”或“负”)极移动。
(2)t1时,原电池中电子流动方向发生改变,其原因是________。
Ⅱ.下图所示电化学装置中,a为足量的电解质溶液,X、Y是两块电极板。
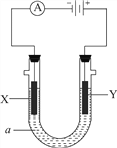
请回答:
(3)若X、Y都是石墨电极,a是含有酚酞的饱和NaCl溶液,则在X电极附近观察到的现象是________,检验Y电极上反应产物的化学方法及实验现象是________,电解池总反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p1B. 1s22s22p3C. 1s22s22p5D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素类药物中间体G(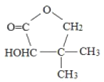 ),可按如下线路含成:
),可按如下线路含成:
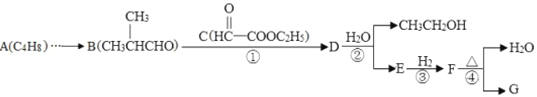
其中A~G分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知: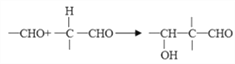
完成下列填空:
(1)A的名称是__________________,F的官能团_________________。
(2)写反应类型:反应①______________,②______________。
(3)G可以转化为化合物M(C6H10O),写出满足下列条件的2种M的结构简式:______、_______。
①分子中除羟基外还有一种碳碳不饱和键;②链状且不存在![]() 结构;
结构;
③分子中只有3种不同化学环境的氢原子。
(4)设计一条由A制备B的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com