
【题目】下表中物质的分类组合完全正确的是( )
编组 | A | B | C | D |
强电解质 | NaCl | H2SO4 | CaCO3 | H2S |
弱电解质 | HF | BaSO4 | HClO | NH3·H2O |
非电解质 | Cl2 | CS2 | CH4 | 蔗糖 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏
①把饱和食盐水中的食盐提取出来
②把碘水中的碘提取出来
③用海水制取蒸馏水
④除去氧化钙中的碳酸钙
⑤分离柴油和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )

A. c点处正反应速率和逆反应速率相等
B. a点处正反应速率比b点处的大
C. d点(t1时刻)和e点(t2时刻)处n(N2)不同
D. t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基本操作正确的是( )
A.手持试管给试管里的物质加热
B.用燃着的酒精灯去点燃另一盏酒精灯
C.用天平称取药品时用手直接拿砝码
D.用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
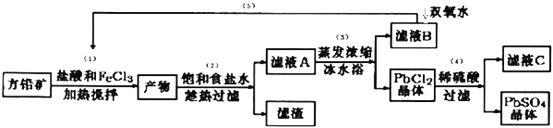
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5]有机化学基础:有机物丙(C13H18O2)是一种香料.其可由甲和乙在浓硫酸催化作用和加热条件下合成:

已知以下信息.:
①甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰;
②乙为香醇的同系物.香醇的结构简式为:
③![]()
回答下列问题:
(1)A的名称为____________。
(2)B的分子式为______________。
(3)C与新制碱性Cu(OH)2反应的化学方程式为____________。
(4)丙中有两个甲基.在一定条件下,1 mol D可以和2 mol H2反应生成乙.D可以发生银镜反应.则D 的结构简式为____________。
(5)甲与乙反应的化学方程式为______________,该反应类型为_________________:
(6)甲的同分异构体中含有“COO”结构的共有_____________种(不包含甲),其中核磁共振氢谱为3组 峰。且峰面积之比为6:1:1的为______________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.如图所示为晶体A的结构,已知晶体A仅由一种元素X组成。X的一种单质可由金属镁与XY2气体加热反应获得。请回答下列问题:

(1)晶体A的名称为__________。
(2)晶体A中X原子的杂化方式为________。
(3)每个A原子参与形成______个6元环。
(4)将每个X原子视为一个球,若X原子的半径为R,1个晶胞中X原子的总体积为V,设一个晶胞的体积为V0,定义堆体积系数α=![]() ,则该晶体的堆积系数α=_____(保留1位有效数字,取
,则该晶体的堆积系数α=_____(保留1位有效数字,取![]() ,π≈3)
,π≈3)
(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线四等分点)
II.由分子光谱测得的断裂1个化学键所需的能量称为光谱解离能(D0),1个化学键包含的原子相互作用能称为平衡解离能(D1),两者的关系为![]()
实验测得X-X键振动频率γ=2×1014Hz;
普朗克常数h=6×10-34J·s
阿伏伽德罗常数NA=6×1023mol-1
X为光谱常数。平衡解离能的计算式为![]() ;
;
由实验测得D1=6×10-19J;
用阿伏加德罗常数NA乘D0得到断裂1mol化学键所需的能量E,E称为键能:E=NAD0。
请回答下列问题:
(1)X-X键的键能为______kJ/mol。
(2)1mol晶体A中有_____molX-X键。
(3)原子化热的定义为:断裂lmol晶体中所有化学键需要吸收的热量。原子晶体的原子化热类似于离子晶体的晶格能,那么晶体A的原子化热为______kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com