
| A. | 0.46g | B. | 0.69g | C. | 0.92g | D. | 0.23g |
分析 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL c(OH-)=1mol/L的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-),据此计算.
解答 解:将一定量的钠铝合金置于水中,合金全部溶解,得到20mLc(OH-)=1mol/L的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-)=0.04mol×1mol/L=0.04mol,根据钠元素守恒可知原合金中钠为0.04mol,所以原合金中钠的质量为0.04mol×23g/mol=0.92g,
故选:C.
点评 考查钠铝及其化合物的性质、根据方程式的计算等,难度中等,利用守恒计算,清楚反应过程判断n(Na+)=n(Cl-)是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应为放热反应 | |
| B. | 图中P点:v(正)>v(逆) | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.016mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
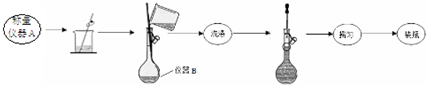
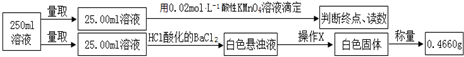
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D20的混合物中所含中子数为NA | |
| B. | 等物质的量的水与重水含有的中子数相等 | |
| C. | 18gD20和18gH20中含有的质子数均为10NA | |
| D. | 235g核素$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U发生裂变反应:$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U+$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n$\frac{\underline{\;裂变\;}}{\;}$$\left.\begin{array}{l}{90}\\{38}\end{array}\right.$Sr+$\left.\begin{array}{l}{136}\\{54}\end{array}\right.$U+10$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n净产生的中子($\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n)数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,则溶液中一定含有Fe2+ | |
| D. | 若金属有剩余,不可能只有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
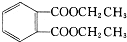 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: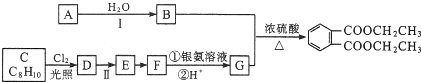
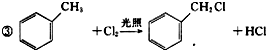
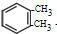 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$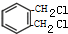 +2HCl.
+2HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- | |
| C. | 能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中:Mg2+、Na+、F-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com