
【题目】298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是
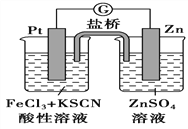
A. 正极反应为Zn-2e-=Zn2+
B. 该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+
C. Pt电极上有气泡出现
D. 左烧杯中溶液的红色变浅
科目:高中化学 来源: 题型:
【题目】已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。某反应2AB(g)C(g)+3D(g)在高温时能自发进行,在低温下不能自发进行,则该反应的正反应的△H、△S应为
A.ΔH<0,△S<0B.△H<0, △S>0
C.△H>0,△S<0D.△H>0,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为__________________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________________________________。
(3)实验室利用下图装置制取无水AlCl3。
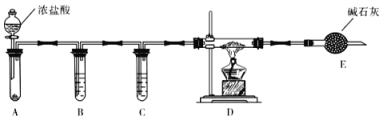
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是____________________________
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________ 。
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。
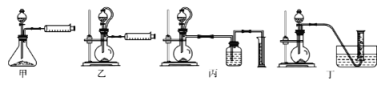
从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是
①液态水的汽化②将胆矾加热变为白色粉末③浓硫酸稀释④KClO3分解制氧气⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解⑦CO2+C![]() 2CO⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C(s)+H2O(g)
2CO⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C(s)+H2O(g)![]() CO(g)+H2(g) ⑩Al与HCl反应
CO(g)+H2(g) ⑩Al与HCl反应
A. ②③④⑤⑥⑦⑧⑨ B. ②③④⑧⑨
C. ②④⑥⑧ D. ②④⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求填空:
(1)有SO2、CH3COOH、BaSO4、CH3CH2OH四种物质,属于非电解质的是_________、__________;属于强电解质的是________________;属于弱电解质的是_______________。
(2)写出下列物质在水溶液中电离的方程式
①NaHCO3:__________________________________________;
②HClO:_______________________________________________。
(3) 写出MgCl2的电子式 ___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为( )
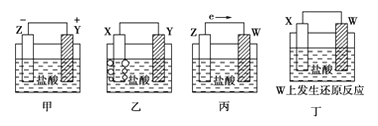
A. Z>Y>X>WB. Z>X>Y>WC. Z>Y>W>XD. Y>Z>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
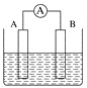
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com