
【题目】下列有关反应速率的说法中正确的是( )
A. 氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率
B. 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C. 用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D. 二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 22g3H2O中所含中子的数目为12NA
B. 1LpH=1 H3PO4溶液中所含H+的数目为0.1NA
C. 叠氮化铵(NH4N3)发生爆炸反应:NH4N3==2N2↑+2H2↑,当产生标准状况下22.4L气体时,转移电子的数目为NA
D. 1mol乙酸与3molC2H5OH充分反应生成CH3COOC2H5分子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图1所示.
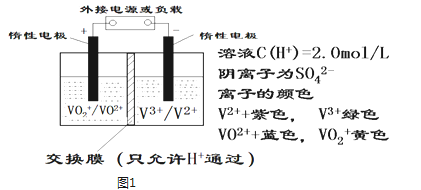
①当左槽溶液逐渐由黄变蓝,其电极反应式为 ___ .
②充电过程中,右槽溶液颜色逐渐___ 色变为___ 色.
③放电过程中氢离子的作用是___ ___ ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 ___ .
(1)若负载是镀铜的电镀槽,则纯铜应该连接___ 槽(填左或右)中的电极.
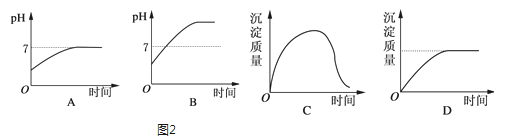
(2)若负载是用石墨作电极,用3mol/L KCl和0.5mol/L Al2(SO4)3的混合溶液作电解液的电解池时,图2电解变化的曲线合理的是___
(3)电解法处理污水已经得到广泛的应用.若负载是酸性介质中将有毒的Cr2O72﹣转变为Cr3+的电解池.装置如图3所示,请用文字描述其工作原理___
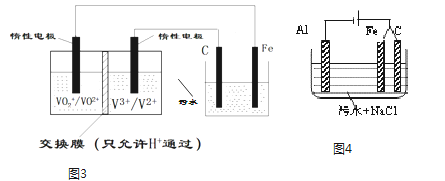
(4)若负载是进行三电极法污水处理的电解池原理如图4所示,增加的铁电极的可能作用是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A. H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2 +I2(g)![]() 2HI)
2HI)
B. 合成氨时,将混合气体中的NH3液化有利于提高产率
C. 实验室用排饱和食盐水的方法收集氯气
D. 滴加酚酞的氨水中加入氯化铵固体后红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:

回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中,正确的是( )
A.氯气、液氯和氯水是同一种物质
B.新制氯水可以使干燥的有色布条褪色
C.氯水因为具有剌激性气味,所以可以杀灭细菌和病毒
D.液氯比氯水的漂白作用更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于非金属元素的叙述中正确的是( )
A.非金属元素的最外层电子数都大于或等于4
B.非金属元素的原子都易得电子生成相应的阴离子
C.只有非金属元素组成的化合物一定属于共价化合物
D.每一个主族包含的元素中不一定都有非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com