
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图1所示.
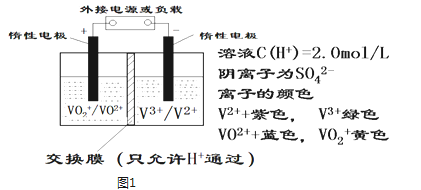
①当左槽溶液逐渐由黄变蓝,其电极反应式为 ___ .
②充电过程中,右槽溶液颜色逐渐___ 色变为___ 色.
③放电过程中氢离子的作用是___ ___ ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 ___ .
(1)若负载是镀铜的电镀槽,则纯铜应该连接___ 槽(填左或右)中的电极.
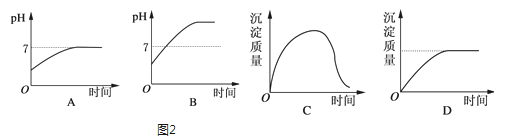
(2)若负载是用石墨作电极,用3mol/L KCl和0.5mol/L Al2(SO4)3的混合溶液作电解液的电解池时,图2电解变化的曲线合理的是___
(3)电解法处理污水已经得到广泛的应用.若负载是酸性介质中将有毒的Cr2O72﹣转变为Cr3+的电解池.装置如图3所示,请用文字描述其工作原理___
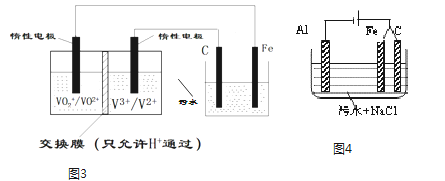
(4)若负载是进行三电极法污水处理的电解池原理如图4所示,增加的铁电极的可能作用是___
【答案】 VO2++2H++e﹣=VO2++H2O 绿 紫 参与正极反应 通过交换膜定向移动使溶液成电中性 0.5mol 左 AD 阳极的金属铁放电得到的亚铁离子将Cr2O72﹣还原为Cr3+ 产生促使污物聚沉的Fe(OH)3
【解析】①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,故可以看到右槽溶液颜色逐渐由绿色变为紫色,故答案为:绿;紫;
③放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使溶液成电中性;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5mol,则氢离子变化0.5mol,故答案为:参与正极反应;通过交换膜定向移动使溶液成电中性;0.5mol;
(1)若负载是镀铜的电镀槽,则纯铜为阳极,应该连接电源的正极,即左槽,故答案为:左;
(2)假设混合溶液的体积为1L,则n(Cl-)=0.3mol,n(Al3+)=0.1mol,离子放电顺序为H+>Al3+>Na+,Cl->OH->SO42-,阳极发生:2Cl--2e-═Cl2↑,Cl-离子全部放电,失去0.3mol电子,阴极反应为2H++2e-═H2↑,得到0.3mol电子,生成0.3molOH-,发生Al3++3OH-═Al(OH)3↓,剩余溶液为K2SO4,溶液呈中性,pH=7,继续电解,为电解水,溶液pH不变,沉淀不溶解,所以图2电解变化的曲线合理的是AD,故答案为:AD;
(3)铁电极连接原电池的正极,为电解池的阳极,则铁失去电子生成亚铁离子,亚铁离子将Cr2O72-还原为Cr3+,发生反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故答案为:阳极的金属铁放电得到的亚铁离子将Cr2O72-还原为Cr3+;
(4)根据图示可知,阳极为C时生成氯气,阳极为Fe时溶液中产生亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁易被氯气氧化成氢氧化铁,氢氧化铁具有很强吸附性,可以净水,故答案为:产生促使污物聚沉的Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH(g)ΔH2=+23.4 kJ·mol-1
(1)反应2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
(2)一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a.正反应速率先增大后减小 b.H2的转化率增大
c.生成物的体积百分含量增大 d.容器中的![]() 值变小
值变小
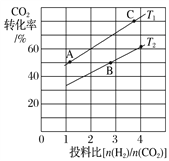
(3)在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将4mol CO2和8 mol H2充入2 L的密闭容器中,10min 后反应达到平衡状态,则0~10min内的平均反应速率v(CH3OCH3)=________________;KA、KB、KC三者之间的大小关系为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )。
A. 2F2+2H2O==4HF+O2 B. C+H2O![]() CO+H2
CO+H2
C. 2Na+2H2O==2NaOH+H2↑ D. Cl2+H2O==HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E不可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法中正确的是( )
A. 氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率
B. 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C. 用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D. 二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com