
【题目】下列措施中,能减慢化学反应速率的是( )
A. 将块状固体药品研细后再反应
B. 将食物存放在温度低的地方
C. 用 MnO2 作H2O;分解反应的催化剂
D. 用 4 mol/L H2SO4 溶液代替 1 mol/L H2SO4 溶液与锌粒反应
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】已知:(1)H2(g)+ ![]() O2(g)═H2O(g);△H=a kJ/mol
O2(g)═H2O(g);△H=a kJ/mol
2)2H2(g)+O2(g)═2H2O(g);△H=b kJ/mol
3)H2(g)+ ![]() O2(g)═H2O(l);△H=c kJ/mol
O2(g)═H2O(l);△H=c kJ/mol
4)2H2 (g)+O2(g)═2H2O(l);△H=d kJ/mol
下列关系式中正确的是( )
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl﹣、Br ﹣、I﹣、SO42﹣、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图: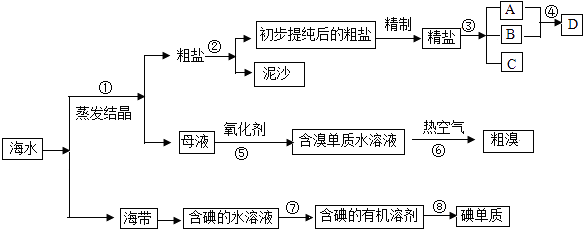
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②⑧ .
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是 .
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式 .
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是 .
A.②③④①
B.③④②①
C.④③②①
D.③②④①
(5)若用来提取Br2 , 反应⑤所用的氧化剂的来源较合理的是 .
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有性,该方法对比有机溶剂萃取法的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏伽德罗常数的值,下列有关叙述正确的是( )
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D.1 mol Fe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)NH2COONH4(s)
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
(1)该反应在一定条件下能够自发进行,则反应的△H0.(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式 .
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置气密性.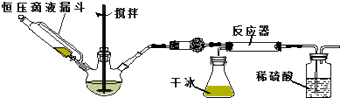
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水.
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品…
①干燥管中盛放的药品是 .
②对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有 , .
③以恒压滴液漏斗代替分液漏斗的目的是 .
④反应后期CO2气流量下降时,可采取的相应措施是 .
(4)该实验装置可能面临的安全问题是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的原子序数为 ( )
A. 111 B. 161 C. 272 D. 433
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaNO2+NH4Cl=NaCl+N2↑+2H2O制备N2,下列说法正确的是( )
A. NaNO2发生氧化反应
B. NH4Cl中的氮元素被还原
C. N2既是氧化产物,又是还原产物
D. 每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com