
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)NH2COONH4(s)
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
(1)该反应在一定条件下能够自发进行,则反应的△H0.(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式 .
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置气密性.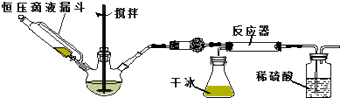
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水.
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品…
①干燥管中盛放的药品是 .
②对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有 , .
③以恒压滴液漏斗代替分液漏斗的目的是 .
④反应后期CO2气流量下降时,可采取的相应措施是 .
(4)该实验装置可能面临的安全问题是 .
【答案】
(1)小于
(2)NH3+CO2+H2O=NH4HCO3
(3)固体氢氧化钠或碱石灰;不需要干燥;提供低温环境,提高转化率;使氨水顺利滴下;调节恒压滴液漏斗旋塞,减慢氨水滴加速度
(4)产品易堵塞导管,稀硫酸会倒吸
【解析】解:(1)2NH3(g)+CO2(g)NH2COONH4(s),该反应为熵减的过程,若能自发进行,说明该反应为放热反应,即△H<0,所以答案是:小于;(2)水会和氨气、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;所以答案是:NH3+CO2+H2O=NH4HCO3;(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,所以答案是:固体氢氧化钠或碱石灰;②碳酸盐和酸反应制CO2 , 则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2 , 不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率,所以答案是:不需要干燥;提供低温环境,提高转化率;③和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,所以答案是:使氨水顺利滴下;④反应后期,由于二氧化碳的气流下降,导致通入的二氧化碳气体减少,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水的滴加速度,所以答案是:调节恒压滴液漏斗旋塞,减慢氨水的滴加速度;(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸,所以答案是:产品易堵塞导管,稀硫酸会倒吸.


科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量的下列溶液,一段时间后停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A.CuCl2(H2O)
B.NaOH(Na2O)
C.CuSO4(CuO)
D.NaCl(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
A.食盐和蔗糖的熔化B.钠和硫熔化
C.碘和冰升华D.SiO2和Na2O熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施中,能减慢化学反应速率的是( )
A. 将块状固体药品研细后再反应
B. 将食物存放在温度低的地方
C. 用 MnO2 作H2O;分解反应的催化剂
D. 用 4 mol/L H2SO4 溶液代替 1 mol/L H2SO4 溶液与锌粒反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在共价化合物中一定含有共价键
B. 含有共价键的化合物一定是共价化合物
C. 含有离子键的化合物一定是离子化合物
D. 离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与座标图形相符合的是( )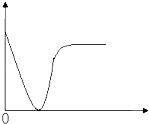
A.稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B.铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C.CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
已知:①CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.8kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
(1)写出由CO2和H2反应合成CH3CH2OH(l)和H2O(l)的热化学方程式
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景.该燃料电池中,使用铂作电极,KOH溶液做电解质溶液.通入乙醇燃气的一极为极,该极上的电极反应式为 .
(3)用乙醇燃料电池电解400mL 饱和食盐水装置可简单表示如图:该装置中发生电解反应的方程式为;在铁棒附近观察到的现象是;当阴极产生448mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 . (不考虑气体的溶解及溶液体积的变化) 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com