
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是: ( )
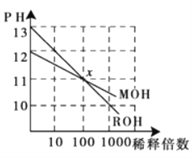
A. ROH是一种强碱
B. 在x点,MOH并没有完全电离
C. 在x点,c(M+)=c(R+)
D. 稀释前,c(ROH)=10c(MOH)
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断该可逆反应正反应为吸热反应
B. 若②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,则乙对应的压强大
3C(g)+D(s)的影响,则乙对应的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶被中的Fe3+,可向溶液中加入适量CuO,调节pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法正确的是( ) 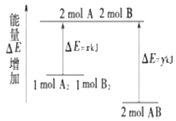
A.该反应是吸热反应
B.断裂 1molA﹣A 键和 1mol B﹣B 键放出 xkJ 能量
C.断裂 2molA﹣B 键需要吸收 y kJ 的能量
D.1molA2和 1molB2 的总能量低于 2molAB 的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3 , 还有少量的Fe2O3、SiO2提取冶炼铝的原料氧化铝.工艺流程如图:(每步所加试剂均稍过量) 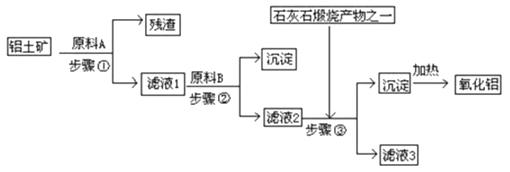
(1)步骤①中所得残渣的成分是(用化学式表示)、流程中分离固体和溶液的方 法是 , 所用到的玻璃仪器有烧杯、玻璃棒和 .
(2)步骤③中若加入过量的石灰石煅烧产物,则滤液3的成分是 , 该反应的 离子方程是: .
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化 铝的提取有什么影响 .
(4)实验室里常向AlCl3溶液中加入氨水来制取Al(OH)3 , 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 糖类化合物也可称为碳水化合物
B. 维生素D可促进人体对钙的吸收
C. 蛋白质是仅由碳、氢、氧元素组成的物质
D. 硒是人体必需的微量元素,但不宜摄入过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
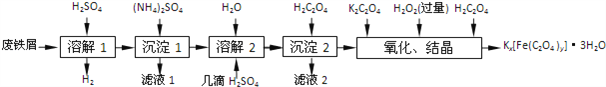
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
已知:(NH4)2SO4、FeSO47H2O、莫尔盐[(NH4)2SO4FeSO46H2O]的溶解度如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO47H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ |
(NH4)2SO4FeSO46H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)“溶解1”应保证铁屑稍过量,其目的是______.“溶解2”加“几滴H2SO4”的作用是______.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、______、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是______.
(3)“沉淀”时得到的FeC2O42H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是______.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是______.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4
步骤3:向步骤2所得溶液中______加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c molL﹣1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com