
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
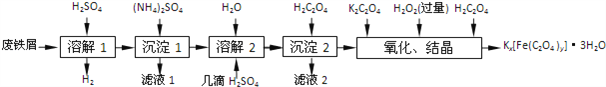
已知:(NH4)2SO4、FeSO47H2O、莫尔盐[(NH4)2SO4FeSO46H2O]的溶解度如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO47H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ |
(NH4)2SO4FeSO46H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)“溶解1”应保证铁屑稍过量,其目的是______.“溶解2”加“几滴H2SO4”的作用是______.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、______、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是______.
(3)“沉淀”时得到的FeC2O42H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是______.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是______.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4
步骤3:向步骤2所得溶液中______加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c molL﹣1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
【答案】 防止Fe2+被氧化为Fe3+ 抑制Fe2+水解 冷却结晶 洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥 用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净 黑暗可以防止晶体分解 加入足量KMnO4溶液 加入稍过量的锌粉.
【解析】本题主要考查对于制备草酸合铁酸钾晶体的实验流程的评价。
(1)2Fe3++Fe![]() 3Fe2+,“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+。FeSO4+2H2O
3Fe2+,“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+。FeSO4+2H2O![]() Fe(OH)2+H2SO4,“溶解2”加“几滴H2SO4”的作用是抑制Fe2+水解。
Fe(OH)2+H2SO4,“溶解2”加“几滴H2SO4”的作用是抑制Fe2+水解。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥,用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥。
(3)检验沉淀是否洗涤干净就是检验沉淀吸附的![]() 等离子是否洗涤干净,方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净。
等离子是否洗涤干净,方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解。
(5)步骤1:准确称取所制备的草酸合铁酸钾晶体ag,配成250mL待测液。
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42﹣转化为CO2被除去。
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中。
步骤4:用cmolL﹣1KMnO4标准溶液滴定步骤3所得溶液至终点,消耗VmLKMnO4标准溶液。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是: ( )
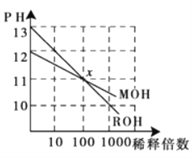
A. ROH是一种强碱
B. 在x点,MOH并没有完全电离
C. 在x点,c(M+)=c(R+)
D. 稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D代表4种元素。请填空:
(1)A原子序数为24的元素原子中有___________个电子层,___________个能级,_________个未成对电子,位于元素周期表的___________区。
(2)B的原子的2p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:__________________________________。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)。
D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D元素基态原子的电子排布式为____________________________,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能正确表示水解的离子方程式是( )
A. CH3COOH + H2O ![]() CH3COO- + H3O+
CH3COO- + H3O+
B. Br- + H2O ![]() HBr + OH-
HBr + OH-
C. CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D. NH4+ + H2O ![]() NH3·H2O + H+
NH3·H2O + H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( )
A. 950mL,111.2g B. 500mL,117g
C. 1000mL,l17g D. 任意规格,117g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属银、熔融硫和多硫化锂分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列关于其说法错误的是
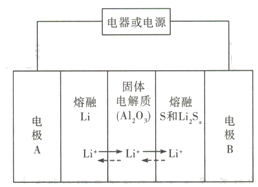
A. 放电时,电极B为正极
B. 充电时内电路中Li+的移动方向为从B到A
C. 该电池的适宜工作温度应该在Al2O3的熔点和沸点之间
D. 充电时,阳极反应为Sx2--2e-=xS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示回答有关问题: 
(1)甲池为(选填“原电池”或“电解池”),
(2)乙池中Zn棒上发生反应的电极反应式为: .
(3)石墨A上收集到1.12L气体(标况下),则反应过程中转移的电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
气体体积/L | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com