
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
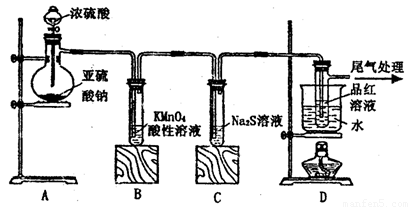
(1)装置A中盛放亚硫酸钠的仪器名称是___________,其中发生反应的化学方程式为_____________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、_____________,这些现象分别说明SO2具有的性质是_________和___________;配平下面离子方程式:
□SO2+□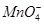 +□H2O=□
+□H2O=□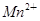 +□
+□ +□H+;
+□H+;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象______________________;
(4)尾气可采用____________________溶液吸收。
(1)蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)溶液由紫红色变为无色;无色溶液中出现黄色浑浊;还原性;氧化性;5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)NaOH
【解析】
试题分析:(1)根据实验装置图,盛放亚硫酸钠的仪器是圆底烧瓶;Na2SO4与浓硫酸反应生成SO2气体、Na2SO4、和H2O,进而可得化学方程式。
(2)二氧化硫中硫元素是+4价,是中间价态,既有还原性,又有氧化性,酸性高锰酸钾有强氧化性,能氧化二氧化硫中+4价的硫,所以二氧化硫能被酸性高锰酸钾溶液氧化而褪色,同时说明二氧化硫有还原性;硫化氢中的硫为-2价,与二氧化硫作用,二氧化硫表现为氧化性,被还原成0价的硫;由化合价升降法可配平离子方程式,Mn元素降低5价,S元素升高2价,求出最小公倍数,进行配平。
(3)二氧化硫具有漂白性,能使品红溶液褪色,但加热褪色后的品红溶液,溶液的颜色能复原。
(4)SO2有毒,能造成污染,所以用NaOH溶液吸收。
考点:考查基本仪器和基本操作、化学方程式的书写、离子方程式的配平、实验现象及分析。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
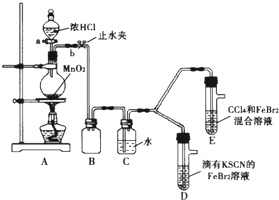 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com