
����Ŀ��һ������Һ̬������XY2����һ������������ǡ����ȫȼ�գ��仯ѧ����ʽ��XY2(l)��3O2(g)![]() XO2(g)��2YO2(g)����ȴ���ڱ�״���²��������������672mL���ܶ���2.56 g��L��1��
XO2(g)��2YO2(g)����ȴ���ڱ�״���²��������������672mL���ܶ���2.56 g��L��1��
��1����Ӧǰ�����������__________��
��2��������XY2��Ħ��������__________��
��3����XY2������X��Y��Ԫ��Ħ����������3��16����X��Y��Ԫ�طֱ�Ϊ__________��__________(��Ԫ�ط���)��
���𰸡�672mL 76g/mol C S
��������
(1)���ݷ���ʽ��֪������ʽ�Ⱥ����ߵ����������֮����ȣ����������������ʵ������ڷ�Ӧ��������������ʵ�����
(2)�������������غ㼰n=![]() ���㣻
���㣻
(3)����Ħ��������XY2������X��Y��Ԫ��Ħ����������3��16���㼴�ɡ�
(1)���ݷ���ʽ��֪������ʽ�Ⱥ����ߵ����������֮����ȣ����������������ʵ������ڷ�Ӧ��������������ʵ�������Ӧǰ�������״̬��ͬ����Ӧ������672mL�����壬�����ĵ����������ҲΪ672mL��
(2)��Ӧ���������=2.56g��L-1��0.672L=1.72g���������������غ㣬������XY2������Ϊ1.72-![]() ��32=0.76g�����ݷ���ʽ��֪XY2�����ʵ���Ϊ������
��32=0.76g�����ݷ���ʽ��֪XY2�����ʵ���Ϊ������![]() ��n(O2)=
��n(O2)=![]() =0.03mol��M(XY2)=
=0.03mol��M(XY2)=![]() =
=![]() =76g/mol��
=76g/mol��
(3)��XY2������X��Y��Ԫ��Ħ����������3��16����X��Ħ������=76��![]() =12g/mol��ΪC��Y��Ħ������=(76-12)��2=32g/mol��ΪS��
=12g/mol��ΪC��Y��Ħ������=(76-12)��2=32g/mol��ΪS��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ûش��������⡣��֪����KMnO4��������Ũ���ᷴӦ���Ƶ�Cl2����H2SiO3������ˮ��
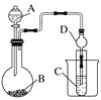
(1)������ͼװ�ÿ�����֤Ԫ�طǽ����Եı仯���ɡ�ͼ��Aװ�õ�������________________�������D��������____________��
(2)ʵ����������ҩƷNa2S��KMnO4��Ũ���ᡢMnO2����ѡ�����ҩƷ���ʵ����֤�ȵķǽ�����ǿ������ƿ�з�����Ӧ�����ӷ���ʽΪ____________________________��װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ_____________________��
(3)��Ҫ�ô�װ��֤�����ԣ�HNO3��H2CO3��H2SiO3������֤���ǽ����ԣ�N��C��Si������������������ѡ����ͬѧ��Ƶ�ʵ�����õ������ʣ���ϡHNO3����ϡ���ᡡ��̼��ơ���Na2SiO3��Һ����SiO2���Լ�A��C�ֱ�Ϊ________(�����)���Թ��з�����Ӧ�����ӷ���ʽΪ__________________����ͬѧ��Ϊ��ʵ�鲻��˵��N��C��Si�ķǽ�����ǿ��������Ϊԭ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�á�
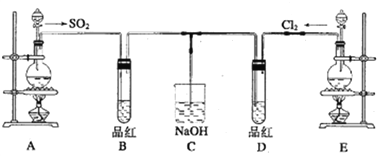
��1��ʵ������װ��A�Ʊ�SO2��ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������©����Һ��δ��������ͬѧ������������ʹ��Һ©��Һ��˳������___________________________��
��2��ʵ������װ��E�Ʊ�Cl2���䷴Ӧ�Ļ�ѧ����ʽΪ____________________����ʵ����������KMnO4��Ũ���ᷴӦ��Cl2����Ӧ�����ӷ���ʽΪ________________________��
��3����Ӧ��ʼһ��ʱ��۲쵽B��D�����Թ��е�Ʒ����Һ����ɫ��ֹͣͨ�����ٸ�B��D�����Թֱܷ�����������Թ��е�����ֱ�Ϊ��
B��_______________________��D��_________________________��
��4������B��Ʒ�컻��Na2S��Һ��ͨSO2һ��ʱ���B������Ϊ_____________________��
��5����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ��(�û�ѧ����ʽ��ʾ)_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��Na2O2��ˮ�ķ�Ӧ��ʵ����ͼ������֪��H2O2 ![]() H+ + HO2-��HO2-
H+ + HO2-��HO2- ![]() H+ + O22-�����з�������ȷ����
H+ + O22-�����з�������ȷ����
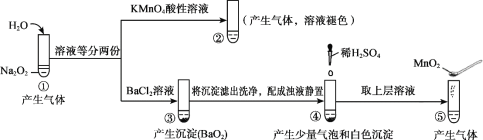
A. �١����в�����������ʹ�����ǵ�ľ����ȼ
B. �١����о�������������ԭ��Ӧ���ֽⷴӦ
C. �ڡ�����KMnO4��MnO2�����ò�ͬ�������������Ҳ��ͬ
D. ͨ�����ܱȽ����ԣ�HCl��H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��������Һ�п��ܺ���K����Fe2����Fe3����Mg2����Ba2����NH4+��Cl����SO42-��NO3���е����������ӡ�ijͬѧȡ50 mL����Һ��������ʵ�飺
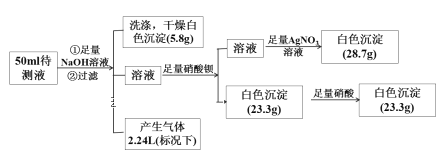
�ش��������⣺
(1)ԭ��Һ�п϶����ڵ�������____________ ���϶������ڵ�������______________ ��
(2)ԭ��Һ�п��ܴ��ڵ�������______________ ��
(3)ԭ��Һ��Cl-��Ũ��Ϊ______________ ��
(4)ԭ��Һ��c(K+)��Χ��_______________ ���������ڣ�˵�����ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����9.8g H2SO4�����ʵ���Ϊ______mol��Լ����________��H2SO4 ����
�ڱ�״���£�22.4LH2������Ϊ__________ g
�۽�30mL0.5mol/LNaCl��Һ��ˮϡ�͵�500mL,ϡ�ͺ�NaCl��Һ�����ʵ���Ũ��Ϊ__________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2Fe(SO4)26H2O����Է�������392]�����ֳ�Ī���Σ��������뵫ȴ��һ����������ȶ�����˹㷺Ӧ������ҩ������Լ������������ش�������֮�йص����⣺
(1)��Ī�������漰������Ԫ���У�
��SԪ�����Ž��з�Ԫ�����ڱ��е�λ���� ______________ ��
�����д���ͬ���������Ԫ�طǽ����Ը�ǿ���ǣ�_____________��
(2)Ϊ����Ī�����Ƿ���ʣ����õ��Լ�Ϊ_______________��
���Ǻϳ������״�ټ��ص���Ҫԭ�ϣ�ʳ���м�KIO3���ҹ�Ϊ����ձ��Ե�ȱ������Ĺ��ҹ涨����ͼ���Զ���λ�ζ����ⶨʳ���е⺬����ʵ����̣�
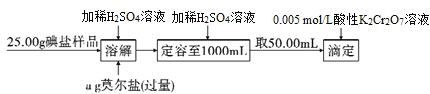
(3)��֪���ܽ���������IO3-�Ļ�ԭ����Ϊ�ⵥ�ʣ�д���÷�Ӧ�����ӷ�Ӧ����ʽ��______________________________��
(4)ȡ50. 00 mL��Ʒ����0.005 mol/L����K2Cr2O7��Һ�ζ�ʣ��Fe2+���ζ�����ʱʹ�õ���ƿδ������½��_____________������ƫ������ƫС��������Ӱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��10�£��й���ѧ����������Ϊ���������Ϳ�űҩ���������أ����ŵ��������ѧ��ҽѧ���������ؿ�����éȩΪԭ����ȡ������˵������ȷ���ǣ� ��
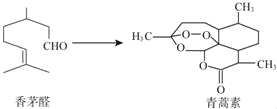
A����éȩ��ʹBr2��CCl4��Һ��ɫ
B�������ط���ʽΪC15H22O5
C����������һ�������¿ɷ���ˮ�ⷴӦ
D�����߾��������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������ͼװ�ã�����NH3�����������MxOy��Ӧ����M��N2��H2O��ͨ����������ˮ���������ⶨM�����ԭ��������a���Լ���Ũ��ˮ��

������a������Ϊ_________������b��װ����Լ�������___________��
�ڰ�����������ȷ��װ������˳��Ϊ_________(����ĸ��װ�ÿ��ظ�ʹ��)��
(2)����������һ�ֹ�ҵ�Σ���������������Ӧ�ù㷺��������ͼ��ʾװ��(�г�װ����ʡ��)��ҩƷ��̽���������������ᷴӦ���������ɷ֡�
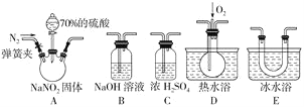
��֪����.NO+NO2+2OH-=2NO2-+H2O
��.����Һ�����¶ȣ�NO2(21��)��NO(-152��)
�ٷ�ӦǰӦ���ɼУ���ͨ��һ��ʱ�䵪����Ŀ����________________��
��Ϊ�˼���װ��A�����ɵ�����������������˳��(������������)��A��_________����װ���������������еIJ�����__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com