
【题目】某无色透明酸性溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-、NO3-中的若干种离子。某同学取50 mL的溶液进行如下实验:
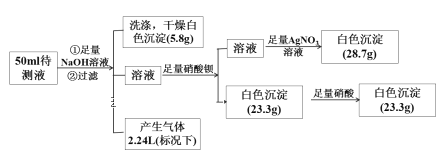
回答下列问题:
(1)原溶液中肯定存在的离子是____________ ,肯定不存在的离子是______________ 。
(2)原溶液中可能存在的离子是______________ 。
(3)原溶液中Cl-的浓度为______________ 。
(4)原溶液中c(K+)范围:_______________ (若不存在,说明理由)
【答案】NH4+、Mg2+、SO42-、Cl-、K+ Fe2+、Fe3+、Ba2+ NO3- 4mol/L c(K+)≥2mol/L
【解析】
无色溶液说明溶液中不含有有色离子Fe2+、Fe3+;由实验流程可知,向50 mL溶液加入足量氢氧化钠溶液,生成5.8g白色沉淀和2.24L气体,说明溶液中含有0.1mol Mg2+和0.1mol NH4+;向反应后的溶液中加入足量的硝酸钡溶液,生成23.3g白色沉淀,加入足量硝酸,沉淀没有溶解,说明溶液中含有0.1molSO42-,不含有Ba2+;再向反应后的溶液中加入足量硝酸银溶液,生成28.7g氯化银白色沉淀,说明溶液中含有0.2mol Cl-;由于实验中没有涉及NO3-的检验,溶液中可能存在NO3-;由溶液中阳离子为0.1mol Mg2+和0.1mol NH4+可知,阳离子电荷数为0.1mol×2+0.1mol=0.3mol,阴离子为0.1molSO42-、0.2mol Cl-和可能含有NO3-可知,阴离子电荷数≥0.1mol×2+0.2mol=0.4mol,由电荷守恒可知,溶液中一定存在K+。
(1)由以上分析可知原溶液中肯定存在的离子是NH4+、Mg2+、SO42-、Cl-、K+,肯定不存在的离子是Fe2+、Fe3+、Ba2+,故答案为:NH4+、Mg2+、SO42-、Cl-、K+;Fe2+、Fe3+、Ba2+;
(2)由于实验中没有涉及NO3-的检验,溶液中可能存在NO3-,故答案为:NO3-;
(3)由分析可知溶液中含有0.2mol Cl-,则50 mL溶液中Cl-的浓度为![]() =4mol/L,故答案为:4mol/L;
=4mol/L,故答案为:4mol/L;
(4)由电荷守恒可知,溶液中存在如下关系2n(Mg2+)+ n(NH4+)+ n(K+)≥2n(SO42-)+ n(Cl-),n(K+)≥0.4mol—0.3mol=0.1mol,则c(K+)≥![]() =1mol/L,故答案为:1mol/L。
=1mol/L,故答案为:1mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是

A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________。
(2)根据等电子原理,写出CO分子的结构式______。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
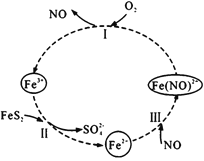
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室配制90mL 1 mol·L-1的NaOH溶液:
(1)用托盘天平称量NaOH的质量为________g。
(2)配制该溶液时需用的主要仪器有烧杯、玻璃棒、胶头滴管、_______________等。
(3)误差下列情况使配制结果偏大的是________。
A.溶解后未冷却即转移、定容
B.定容时仰视容量瓶刻度线
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切
D.托盘天平砝码生锈
E.容量瓶内残有少量蒸馏水
Ⅱ. 某同学学习了铁及其化合物的性质,欲设计实验研究铁及其化合物的部分性质。
(1)该同学根据下图装置做相关实验,请回答下列问题:
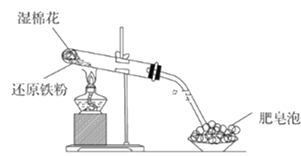
①硬质试管中发生反应的化学方程式为_______________。
②该同学将硬质试管冷却后的少量固体物质溶于稀盐酸得溶液A,向溶液A中滴加KSCN溶液,若溶液未变红色,原因是:________________(用离子方程式表示)。
③该同学向溶液A中滴入一定量的氯水,用该所得溶液腐蚀刻铜板制电路板的主要反应离子方程式___________。
(2)该同学用如下图所示装置制取Fe(OH)2,实验时使用铁屑、6 mol/L硫酸,其他试剂任选。回答下列问题:
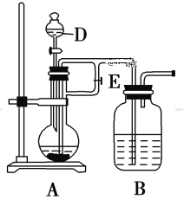
向仪器D中需要放入硫酸,装置B中盛有一定量的NaOH溶液,A中盛有铁屑,实验开始时应先将活塞E打开,待装置中空气排尽后,将活塞E关闭,一段时间后能够长时间观察到装置B中的白色沉淀原因是_____;待A中停止反应后,观察到装置B的白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,写出B中出现该现象的反应方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的氧气中恰好完全燃烧,其化学方程式:XY2(l)+3O2(g)![]() XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56 g·L-1。
XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56 g·L-1。
(1)反应前氧气的体积是__________。
(2)化合物XY2的摩尔质量是__________。
(3)若XY2分子中X、Y两元素摩尔质量比是3∶16,则X、Y两元素分别为__________和__________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是( )
A.分子式为C3H6Cl2的同分异构体有四种
B.分子式为C8H10的芳香烃有3个,分别为 、
、 和
和![]()
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D.二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色
B.化合物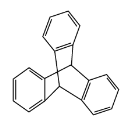 是苯的同系物
是苯的同系物
C.![]() 与苯互为同系物,等质量的
与苯互为同系物,等质量的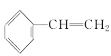 与苯完全燃烧消耗氧气的量相等
与苯完全燃烧消耗氧气的量相等
D.光照条件下,异丙苯(![]() )与氯气发生去取代反应生成的一氯代物有2种
)与氯气发生去取代反应生成的一氯代物有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com