


科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 |
| Cr | 653 | 1592 | 2987 |
| Q | 759 | 1561 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此条件下,可认为NO分解产生O2的反应完全 |
| B、此条件下,2H2O(g)=2H2 (g)+O2(g),此时平衡常数的数值约为5×10-10 |
| C、此条件下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 |
| D、以上说法都不正确 |
查看答案和解析>>
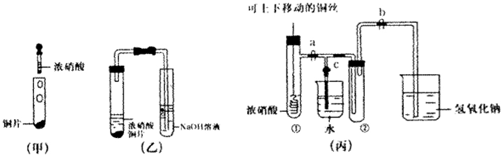
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
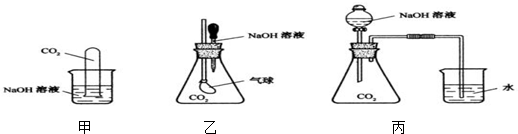
查看答案和解析>>
科目:高中化学 来源: 题型:
| 500℃ |
| 催化剂 |
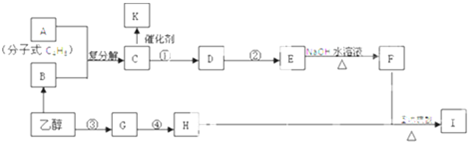
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 操作或现象 |
| A | 制备Fe(OH)3胶体 | 向25mL沸水中逐滴滴加饱和FeCl3溶液5~6滴,并加热至溶液呈红褐色时停止加热 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 测定氯水的pH | 用玻璃棒蘸 取氯水滴在pH试纸上,观察 |
| D | 证明溶液中存在平衡: Fe3++3SCN-?Fe(SCN)3 | 将1 mL KSCN溶液与1 mL 同浓度 FeCl3溶液充分混合;再滴加KSCN溶液,溶液颜色加深 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com