
 .
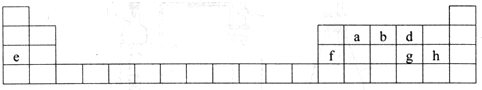
.分析 由元素在周期表的位置可知,a为C,b为N,d为O,e为Na,f为Al,g为S,h为Cl,
(1)同主族从上到下金属性增强,同周期从左向右金属性减弱;
(2)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,非金属性越强,对应氢化物越稳定;
(3)同周期从左向右原子半径减小,同主族从上到下原子半径增大;
(4)a与d形成的化合物X是温室效应气体,X为CO2,为共价化合物;
(5)h、Y两元素原子次外电子层上的电子数相等,h与Y形成的化合物在水溶液中能电离出电子层结构相同的离子,均为18电子离子,则Y为第四周期主族金属元素;
(6)b、h两元素形成的化合物分子中各原子最外层都达到8电子稳定结构,为NCl3,遇水剧烈反应,生成两种产物,其中之一极易溶于水,另一种物质具有漂白性,结合物质的性质及元素守恒可知,生成氨气及HClO.
解答 解:由元素在周期表的位置可知,a为C,b为N,d为O,e为Na,f为Al,g为S,h为Cl,
(1)同主族从上到下金属性增强,同周期从左向右金属性减弱,则上述元素中,Na的金属性最强,故答案为:Na;
(2)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,非金属性越强,对应氢化物越稳定,则a、b、d、g元素的氢化物中,最稳定的是H2O,
故答案为:H2O;
(3)同周期从左向右原子半径减小,同主族从上到下原子半径增大,则f、a、d三种元素原子半径由大到小的顺序排列为Al>C>O,
故答案为:Al>C>O;
(4)a与d形成的化合物X是温室效应气体,X为CO2,为共价化合物,形成过程为 ,
,
故答案为: ;
;
(5)h、Y两元素原子次外电子层上的电子数相等,h与Y形成的化合物在水溶液中能电离出电子层结构相同的离子,均为18电子离子,Y为第四周期主族金属元素,则Y元素的符号可能是K、Ca,故答案为:K、Ca;
(6)b、h两元素形成的化合物分子中各原子最外层都达到8电子稳定结构,为NCl3,遇水剧烈反应,生成两种产物,其中之一极易溶于水,另一种物质具有漂白性,结合物质的性质及元素守恒可知,生成氨气及HClO,反应为NCl3+3H2O=NH3↑+3HClO,
故答案为:NCl3+3H2O=NH3↑+3HClO.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意化学用语及氧化还原反应的使用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 在加热和催化剂作用下,最多能和5mol H2反应 | |
| C. | 能使溴水褪色 | |
| D. | 一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
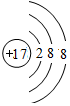 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.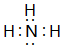 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为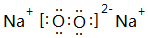 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的原子结构示意图: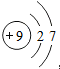 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△S>0的反应在所有温度下都能自发进行 | |
| B. | NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com